Interazioni forti e deboli
INTERAZIONI FORTI E DEBOLI
1) Legami Covalenti (Interazioni forti)
Energia (kcal/mol)
H
|
legame singolo H--C--H ~80
|
H
H H
| |
legame doppio H--C==C--H ~150
H
|
C
legame triplo ||| ~200
C
|
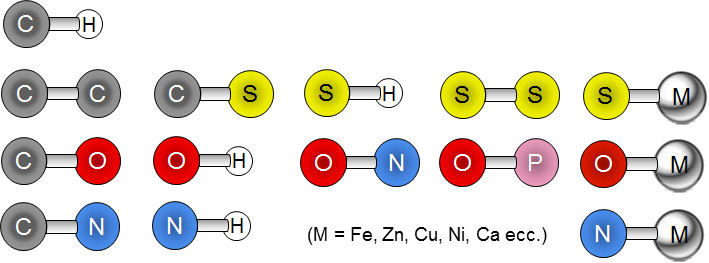
HNelle biomolecole i principali atomi coinvolti nella formazione di legami covalenti sono:
2) Legami Non-covalenti (Interazioni deboli)
Legami elettrostatici: (o ponti salini) fra due specie ioniche di carica opposta. Un esempio banale è il legame che si forma fra uno ione di sodio (na+) e uno ione di cloruro (Cl-). La forza di interazione è data dall'equazione di Coulomb:
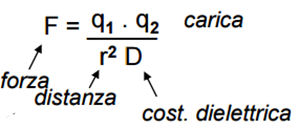
dipendono quindi dalla carica di ciascuna specie (q), dalla distanza al quadrato (r) e da una costante dieletrica (D) che dipende dall'ambiente nelle quali si trovano le cariche.
(o ponti salini) fra due specie ioniche di carica opposta. Un esempio banale è il legame che si forma fra uno ione di sodio (na+) e uno ione di cloruro (Cl-). La forza di interazione è data dall'equazione di Coulomb:

Sono legami relativamente deboli e reversibili, molto dipendenti dall'ambiente (sono assai più deboli in un ambiente acquoso, nel quale la costante dielettrica è di ~80, mentre in un ambiente organico si abbassa notevolmente (~4) risultando in forze di interazione con valori comparabili a quelli di interazioni forti.
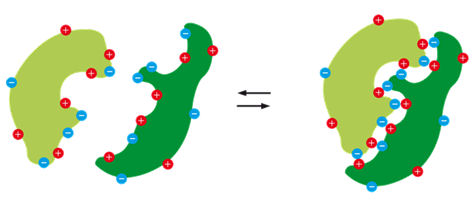
Per quanto riguarda le biomolecole, se le specie cariche si trovano sulla superficie, sono schermate da molecole d'acqua risalutando in interazioni elettrostatiche deboli, mentre se specie con cariche opposte si trovano nel core più organico di macromolecole, formano interazioni forti che agiscono a raggio relativamente lungo, e non sono direzionali.
I principali tipi di interazione elettrostatica nelle macromolecole biologiche sono:
a) interazioni fra gruppi amminici e gruppi carbossilici in amminoacidi e/o polisaccaridi
RCH-COO¯ ::: +N-CHR
b) interazioni fra gruppi amminici o guanidinici e gruppi fosfato in polipeptidi e/o polisaccaridi
OH
|
R-N3+ :::::-O-P-O-R'
|
-O
c) interazioni fra gruppi amminici o guanidinici in polipeptidi e fosfati in acidi nuclieici
OH
|
R-O-P-O¯ ::: +H3N-R
|
O-
Agendo a distanze relativamente estese, i legami elettrostatici sono utili per guidare "l'attracco" (docking) delle biomolecole
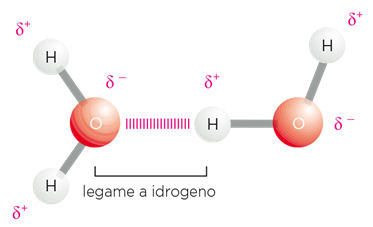
Legami idrogeno: si formano quando un atomo di idrogeno viene condiviso da un atomo atomo elettronegativo (proton donatore) con un'altro atomo altamente elettronegativo (accettore) presenti in due gruppi chimici in prossimità. Sono una forma di attrazione elettrostatica poichè il protone sul donatore ha una deficienza di densità elettronica e quindi è parzialmente positivo (δ+), mentre gli atomi elettronegativi hanno un eccesso di densità elettronica e quindi sono parzialmente carichi negativamente (δ-) .
Un esempio classico sono i legami-H che si formano fra molecole di acqua:
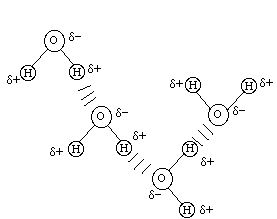
Nelle biomolecole, gruppi proton donatori sono principalmente -OH e -NH. Gruppi proton accettori sono principalmente atomi O e N. I tipi di legami- H che si osservano più comunemente nelle biomolecole sono fra gruppi -OH o -NH proton donatori e atomi proton accettori O e N presenti in gruppi carbonilici, etero-aromatici o fosfato. Non coinvolgono atomi di carbonio o protoni legati ad atomi di carbonio.
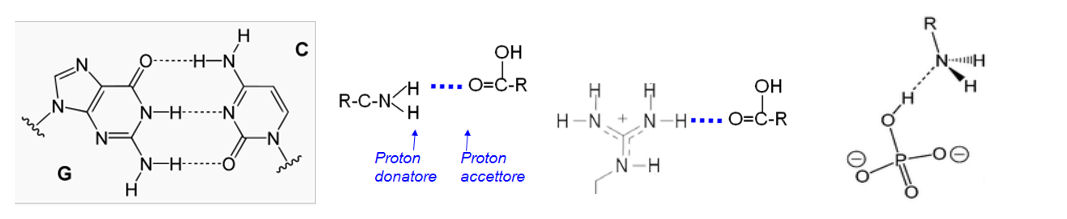 .
.
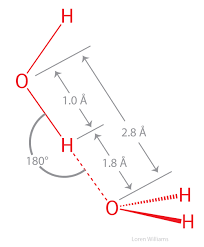
I legami-H necessitano di una precisa distanza (~2.5-3 Å) e orientamento dei proton accettori e donatori.
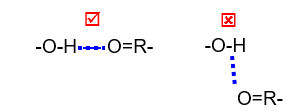
Forze di van der Waals
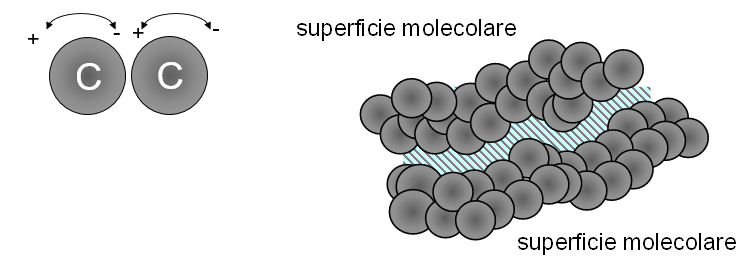
Interazioni molto deboli (generalmente non oltre 1 kcal/mol) che si formano fra molecole (o parti di molecole) non polari. Si creano perché il legame C-H ha un dipolo transiente che induce un dipolo transiente di carica opposta in un'altro legame C-H (sono dovute alle fluttuazioni nella distribuzione delle cariche negli atomi delle molecole).
Le forze di van der Waals sono molto deboli (~1 kjoule) ed agiscono solo a distanza molto ravvicinata; gli atomi devono essere a contatto. Per questa ragione diventano impostanti solo se numerosi atomi in due ampie superfici molecolari (come quelle nelle macromolecole), che hanno una notevole complementarietà di forma, vengono a contatto fra di loro.
Effetto idrofobico
Molecole biologiche non polari (che non posseggono gruppi proton donatori o accettori) non possono formare legami-H con le molecole di acqua nel loro ambiente, e sono quindi insolubili in questo solvente. Sono note come 'molecole idrofobiche'.
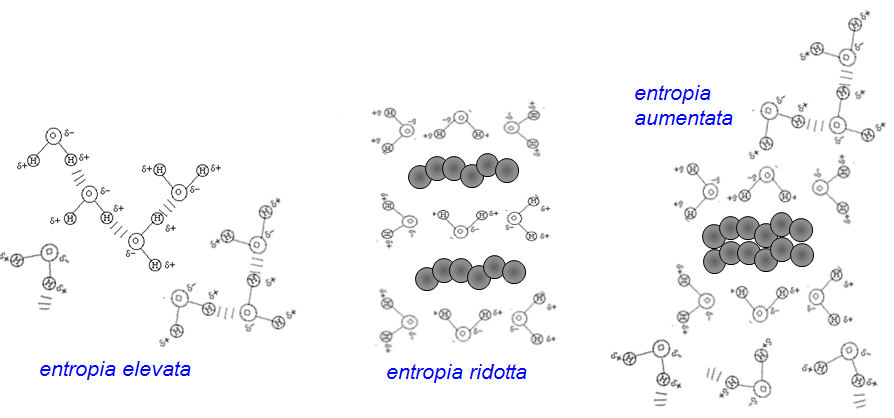
A contatto con H2O, le molecole idrofobiche tendono ad aggregarsi per ridurre l'interazione con il solvente (un classico esempio è una goccia di olio). Per capire l'energetica di queste interazioni, si deve ricordare che le molecole di acqua in una soluzione cercano di formare il massimo numero di legami-H fra di loro. Se sono presenti molecole idrofobiche, non potendo formare legami-H con loro, le molecole d'acqua si devono riorientare per trovare altre molecole d'acqua con cui formare legami-H. Si forma quindi un guscio di molecole d'acqua attorno alle molecole idrofobiche nel quale le molecole d'acqua hanno minore libertà di movimento e sono più ordinate. Questo però abbassa l'entropia e non è energeticamente favorevole.
La soluzione migliore dal punto di vista energetico è quella di forzare tutte le molecole idrofobiche insieme così riducendo l'area della superficie che interrompe la matrice di legami-H e causa la riduzione di entropia.
Interazioni deboli e struttura macromolecolare
Le interazioni deboli determinano la strutturazione di macromolecole in strutture tridimensionali ben definite. Alcune regole che riguardano questa strutturazione sono: