Struttura secondaria
Struttura secondaria e conformazione della catena proteica
(vedi anche la pagina MAcromolecular structure - in inglese)
1) Angoli torsionali
I tre principali angoli di torsione sono phi (φ), psi (ψ), e omega (ω).
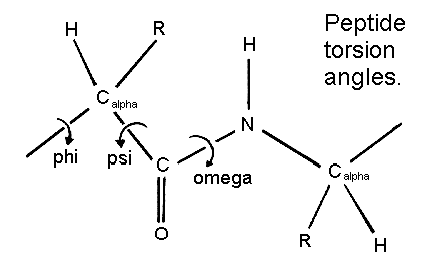
Il legame peptidico è planare e con configurazione trans, dovuto alla delocalizzazione del doppio legame carbonilico sul legame con l'azoto. Questo conferisce natura di doppio legame, impedendo la libera rotazione.
L'angolo torsionale ω ha un valore di 180° e quindi il legame peptidico adotta una configurazione di tipo trans. Solo in rari casi adotta una configurazione cis (ω = 10°), in genere quando sono coinvolti legami peptidici alla prolina (ca. il 5% dei legami a Pro sono con configurazione cis) .
-----------------------------------------------------------------------------------------------------------------------------------------------------------------------------
2) Il Diagramma di Ramachandran
I legami N-Cα e Cα-CO sono relativamente liberi di ruotare (cioè angoli di torsione phi (φ) e psi (ψ), rispettivamente). Ramachandran utilizzo modelli al computer di piccoli peptidi per determinare l'interazione sterica fra gli atomi presenti attorno a questi legami, individuando conformazioni permesse (basso ingombro sterico e quindi bassa energia) e non permesse (alto ingombro sterico, alta energia).
Visualizzò il cosiddetto "Spazio conformazionale permesso" mettendo in grafico cartesiano phi (φ) nell'asse X e psi (ψ) nell'asse Y, ed indicando sul grafico i contorni delle zone a bassa energia . Nel grafico, i valori degli angoli vanno da -180° a +180°, che comunque corrisponde ad una completa rotazione (equivalente ad una variazione da 0° a 360°)

Nel diagramma di Ramachandaran, le zone in bianco corrispondono a conformazioni (combinazioni di angoli φ e ψ) dove gli atomi circostanti si avvicinano troppo l'un l'altro (cioè, i raggi di van der Waals degli atomi si sovrappongono), e che quindi non sono permesse.
Le zone in rosso corrispondono a conformazioni dove gli atomi non entrano in potenziale scontro per motivi sterici e quindi sono permesse. Esse corrispondono alle conformazioni ad α-elica destrogira e a β-foglietto.
Le zone in giallo sono intermedie e corrispondono a conformazioni distorte oppure all'α-elica sinistrogire (nel quadrante in alto a destra).
La glicina, non avendo catena laterale, può assumere conformazioni con angoli φ e ψ in tutti e quattro i quadranti del diagramma, ma gli altri amminoacidi sono ristretti ai due quadranti di sinistra.
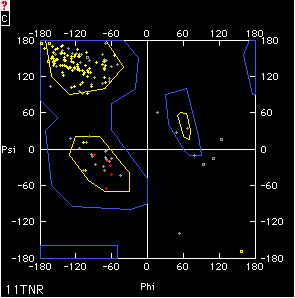
La figura sotto mostra gli angoli φ e ψ reali di una proteina, per ogni residuo la copia di angoli misurati risulta in un punto sul grafico di Ramachandaran.
In questa particolare proteina, i residui con copie di angoli nella zona corrispondente ad un β-foglietto (alto a sinistra) sono più abbondanti di quelli nella zona corrispondente all'α-elica (in mezzo a sinistra). I pochi casi di conformazioni con angoli al di fuori di queste zone (es. a destra del centro) sono residui di glicina.
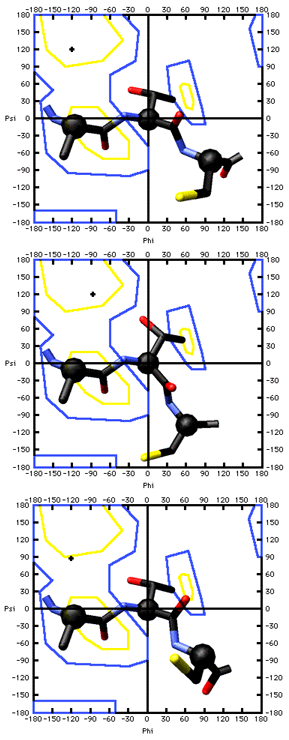
E' possibile osservare l'effetto di una variazione negli angoli torsionali osservando quello che avviene a livello di un segmento con tre residui (-Ala-Thr-Cys-). Nel primo caso gli angoli φ e ψ sono rispettivamente ca. 120° e -120°. Nel secondo, l'angolo ψ cambia a -90°, mentre nel terso è φ che cambia a 90°
-----------------------------------------------------------------------------------------------------------------------------------------------------------------------------
3) L' α-elica.
La conformazione ad α-elica risulta in un andamento a spirale destro-gira della catena proteica. Questo può essere visualizzato su un tratto di catena dove sono omesse le catene laterali per chiarezza. Valori tipici di φ e ψ sono -60 gradi e -50 gradi rispettivamente.In una visualizzazione tipo "stick", gli ossigeni dei gruppi α-carbonilici puntano tutti in avanti, in direzione dell'asse del'elica, direttamente verso i protoni dei gruppi α-amminici 4 residui più in là. La distanza e la direzione sono corrette per la formazione di un legame-H (linee tratteggiate in verde). Se ne formano numerosi lungo tutto il tratto ad α-elica.
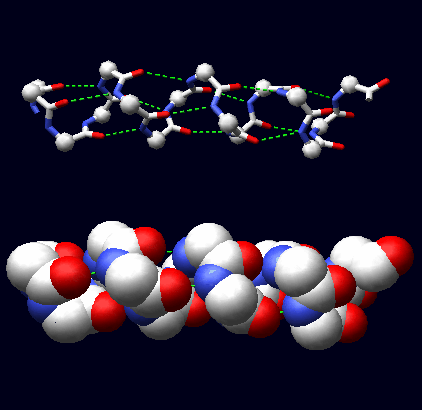
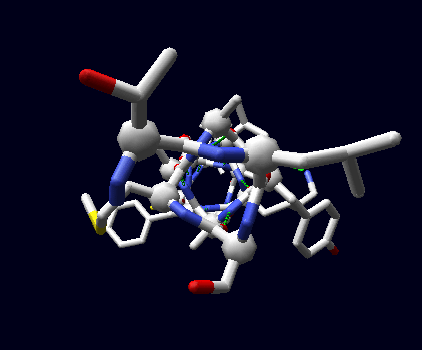
α-elica con asse parallelo al piano della pagina α-elica con asse perpendicolare al piano della pagina
(Ogni gruppo C=O forma un legame-H con un gruppo N-H quattro residui più in là (Oi --- Ni+4) (legami in verde nella figura)
-----------------------------------------------------------------------------------------------------------------------------------------------------------------------------
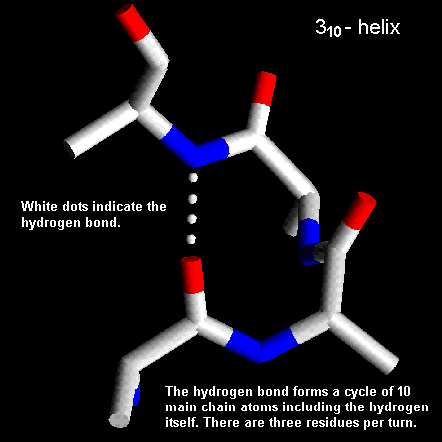
4) Eliche 310.
In questa conformazione si formano legami-H fra un gruppo C=O della catena ed un H-N distante solo 3 residui e 10 atomi di distanza, quindi il nome 310. Di solito i residui con questa conformazione sono presenti solo per tratti brevi della catena ai terminali di unα-elica.
-----------------------------------------------------------------------------------------------------------------------------------------------------------------------------
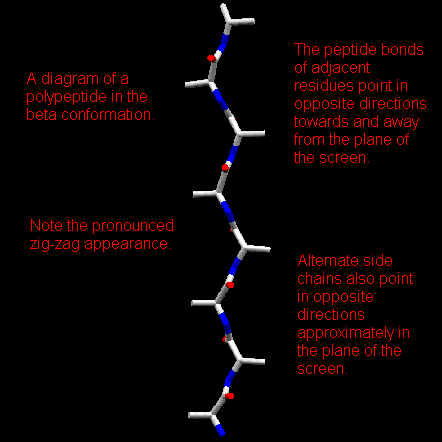
5) Il β-foglietto.
In questa conformazione gli angoli φ sono negativi e quelli ψ sono positivi; tipicamente φ = -140 gradi e ψ = 130 gradi. Un tratto di catena proteica con questa conformazione si definisce un tratto a ' β-struttura', ed alcuni di questi tratti possono interagire mediante legami-H 'intra-segmento' per formare un 'β-f-foglietto'.
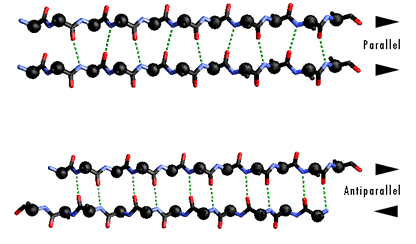
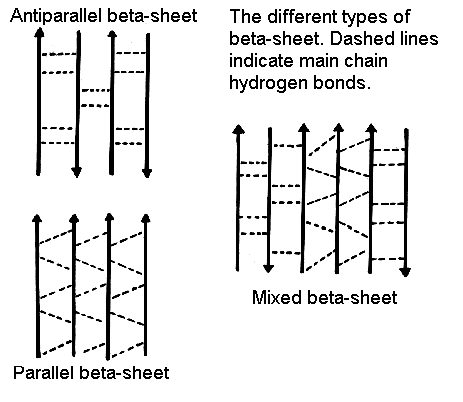
In questo caso, due tratti di catena si accostano in maniera parallela o antiparallela e sono legati da una serie regolare di legami-H fra gruppi C=O e N-H su tratti di catena diversi. Le catene laterali puntano alternativamente sopra e sotto il piano del foglietto.
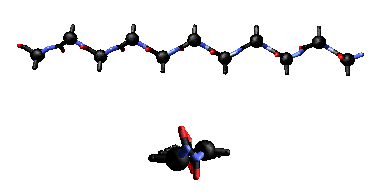
e perpendicolare al piano della pagina (sotto)
Il tipo di legame-H che si forma è diverso nei paralleli ed antiparalleli.
Spesso le β-strutture sono rappresentate come 'nastri', che terminano a punta di freccia in direzione N-termonale --> C-terminale.
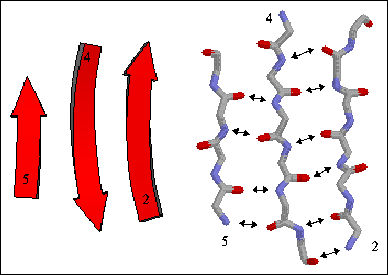

rappresentazione a nastro di β-foglietto prallelo e antiparallelo
I β-foglietti possono essere anche molto ampi, ma sono raramente planari. Tipicamente presentano un piano distorto, e anche l'asse di ciascun β-filamento che li compone può essere assai ricurvo. In alcuni casi il β-foglietto può curvarsi per formare un cosiddetto 'β-barile'.
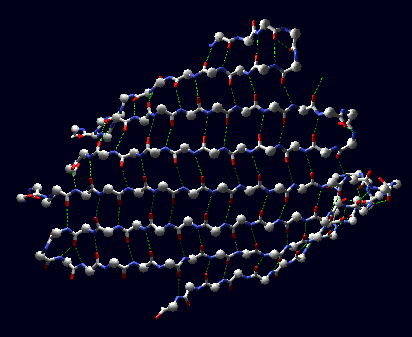

1) β-foglietto distorto 2) β-struttura ricurva 3) β-barile
-----------------------------------------------------------------------------------------------------------------------------------------------------------------------------
6) Ripiegamenti (β-turn e γ-turn)
Questi sono brevi tratti della catena dove cambia direzione repentinamente. Tipicamente sono tratti dove il gruppo C=O di un residuo forma un legame-H con un gruppo N-H tre residui più in là lungo la catena proteica ( Oi --- H-Ni+3).
I ripiegamenti sono molto presenti nelle proteine globulari e spesso si trovano verso la superficie della proteina. Sono divisi in diverse classi in base sugli agli angoli φ e ψ e tipicamente coinvolgono legami-H fra il gruppo C=O di un residuo con quelli NH in posizione i+1 o i+2. Quelli di Tipo I e II mostrati nella figura sono fra i più comuni.
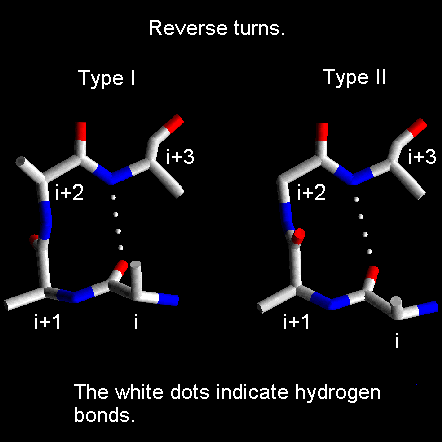
Se un ripiegamento avviene all'interno di un β-foglietto antiparallelo rientra una classe speciale di struttura secondaria nota come β-forcina.

-----------------------------------------------------------------------------------------------------------------------------------------------------------------------------
