Proteine del sistema immunitario
ANTICORPI
Introduzione: Il termine anticorpo è generalmente inteso descriver particolari proteine secrete dai linfociti B attivati (plasmacellule) nei fluidi corporei. Si possono però anche ritrovare come proteine integrali di membrana nei linfociti B, dove fungono da sensori specifici per antigeni, che innesca l'attivazione in plasmacellule.
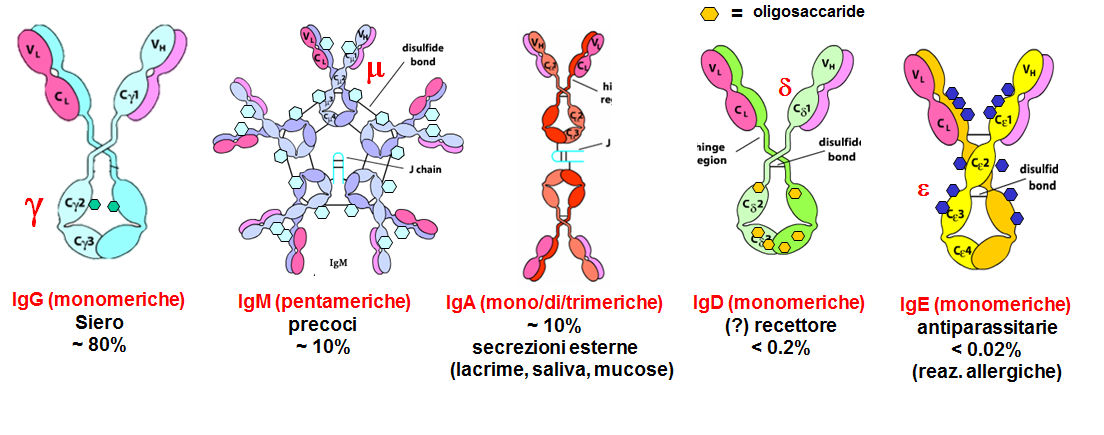
La loro proprietà strategica è appunto quella di legare specifici antigeni. Gli anticorpi (più proriamente immunoglobuline o Ig) dell'uomo sono raggruppati in 5 classi, che si distinguono per la loro struttura e non per la loro specificità antigenica:
IgG, IgM, IgE, IgA e IgD
Cenni storici:
1930: Teoria del templato, o dell'istruzione: si propone che gli anticorpi si assemblano attorno all'antigene (incorretta).
1939: Tiselius ed Elvin Kabat usano le tecniche dell'elettroforesi e dell'immunoprecipitazione per dimostrare che gli anticorpi sono gamma globuline (correttamente)
1940: Linus Pauling propone una teoria del templato revisionata, nella quale l'anticorpo si ripiega in maniera da avvolgere correttamente un antigene (incorretta). Queste teorie continuano a non poter spiegare la discriminazione fra 'self' e 'nonself' (cioè perché selezinano solo antigeni provenienti dall'esterno all'organismo, ma non strutture proprie dell'organismo). Inoltre, si è dimostrato che anticorpi possono essere denaturati e rinaturati in assenza dell'antigene complementare e continuano comunque a riconoscerlo (cioè hanno una capacità innata di riconoscere uno specifico antigene).
Anni 50 e 60: Caratterizzazione molecolare di IgG
- Gerald Edelman tratta IgG con sostanze chimiche (DTT, iodoacetamide e denaturanti) e dimostra che anticorpi sono composti da catene pesanti (H, 50 kDa) e leggere (L, 25 kDa) in proporzioni uguali. Dal peso complessivo dell'anticorpo (150 kDa) deduce che la molecola è composta da due catene H e due catene L.
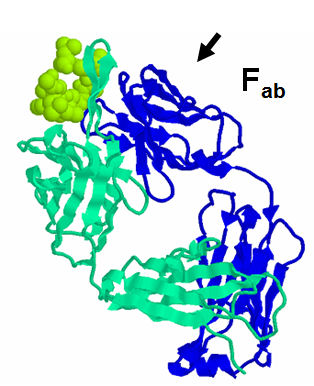
- Allo stesso tempo, Rodney Porter usa la proteasi papaina per scindere una molecola di IgG in tre frammenti di 50 kDa. Due di questi sono identici e legano antigene. Furono denotati Fab (antigen binding fragment). Il terzo non legava antigene ma poteva essere cristallizzato (Fc).
- Porter poi dimostro che i Fab contenevano la catena L scoperta da Edelman.
- Alfred Nisinoff usò diverse proteasi per tagliare IgG. Dai frammenti prodotti dedusse che le catene H e L erano stabilizzate da ponti disolfuro.
Edelman col suo modello di Ig Modello di Porter
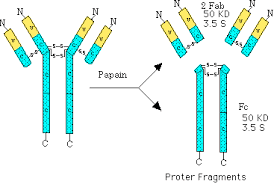
Framentazione delle Ig secondo Nisinoff
Struttura di base:
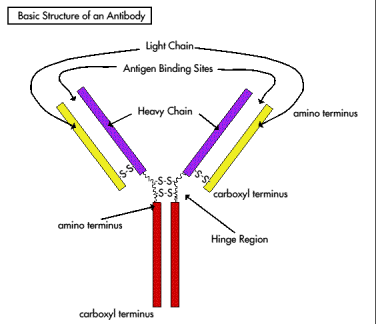
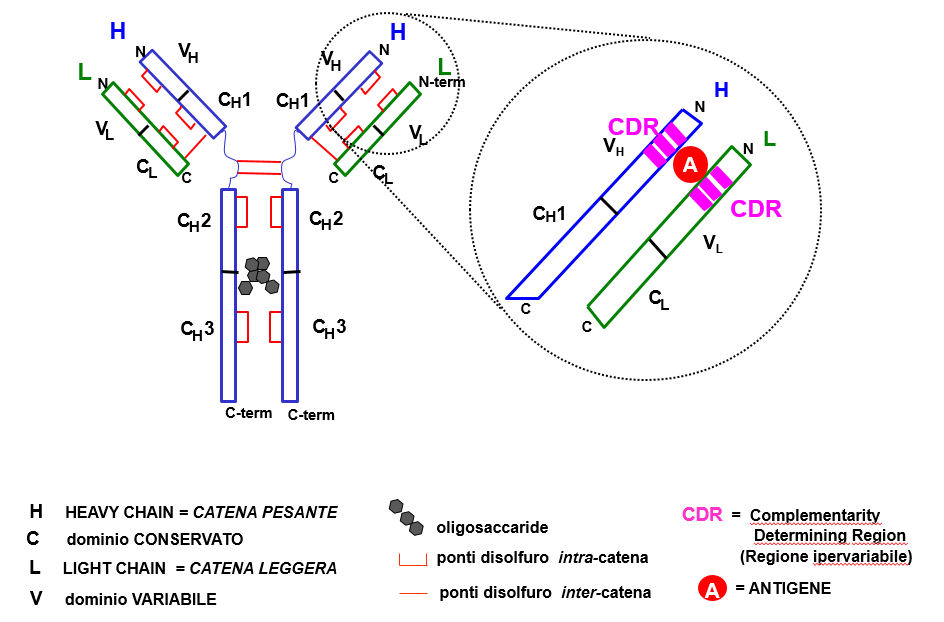
Le molecole IgG sono composte da quattro catene polipeptidiche, due leggere identiche (L) e due pesanti identiche (H), rispettivamente di 25 e 50 kDa per una grandezza totale di 150 kDa.
- Le catene H sono note come catene gamma (γ) e sono diverse in differenti classi di immunoglobuline (es. IgG, IgA, IgM ecc.).
- Tutte le immunoglobuline, di qualunque classe, hanno le stesse catene L. Ci sono due tipi di catena L, denotate kappa (κ) e lambda (λ). Ogni immunoglobulina individuale ha solo un tipo di catena L, o κ o λ.
Nelle immunoglobuline, le diverse catene (H e L) sono tenute insieme da legami non-covalenti e da ponti disolfuro.
- Un lato della molecola, che corrisponde ai frammenti Fab, contiene i siti di legame per l'antigene.
- All'altro lato, che corrisponde allo stelo (frammento Fc) contiene siti coinvolti in funzioni effettrici, quali fissazione (attivazione) del complemento e l'opsonizzazione (predisposizione ad essere fagocitatate) delle cellule infettanti.
- La 'regione cerniera al centro della molecola permette il libero movimento delle braccia Fab dell'immunoglobulina (IgG).
Domini costanti e variabili
L'immunoglobulina è composta da domini modulari con un ripiegamento di tipo β-barile schiacciato, con topologia a chiave greca (vedi la sezione su topologia nella pagina sulla struttura macromolecolare).
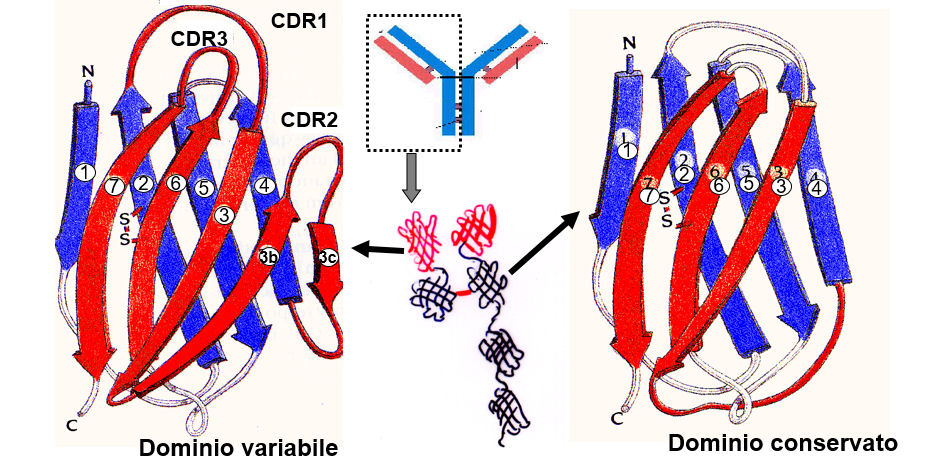
Entrambe le catene L ed H hanno domini conservati (C) e variabili (V). Le catene H hanno 4 domini, con quello variabile all'N-terminale. Le catene leggere hanno due domini, quello variabile all'N-terminale. Il dominio a β-barile variabile VL di una catena leggera (β-foglietto con 9 filamenti, vedi figura in alto a destra) assieme al dominio a β-barile variabile VH di una catena pesante formano il dominio e variabile dell'Ig che contiene il sito recettoriale del braccio Fab (vedi struttura cristallografica sotto). Il dominio a β-barile variabile CL di una catena leggera (β-foglietto con 7 filamenti, vedi figura in alto a destra) assieme ai corrispondente dominio a β-barile variabile CH1 di una catena pesante formano un dominio costante del braccio Fab. I domini a β-barile CH2 e CH3 delle due catene pesanti si associano per formare i domini costanti dello stelo Fc. Da notare che nel dominio CH2, i due domini a β-barile di ciascuna catena non interagiscono direttamente, ma mediante oligosaccaridi covalentemente legati a residui delle catene.
Le sequenze dei domini costanti delle catene leggere che formano Fab (catene κ o λ) sono conservati (simili), considerando due Ig che riconoscono antigeni diversi, e lo stesso si può dire dei domini costanti della catena pesante (γ). Le sequenze dei domini variavili delle catene leggere che formano Fab (catene κ o λ) sono invece variabili (diverse), considerando due Ig che riconoscono antigeni diversi, e lo stesso si può dire dei domini variabili della catena pesante (γ).
Nel dominio variabile, i domini a β-barile hanno due β-filamenti aggiuntivi rispetto ai domini costanti (3b e 3c - edi figura sopra), e i filamenti nel β-foglietto sono connessi da 'loop' più ampi. Questi loop hanno sequenze 'iper-variabili' e formano le cosiddette "Complementarity Determining Regions" (CDR). Queste sequenze formano il sito recettoriale per l'antigene.
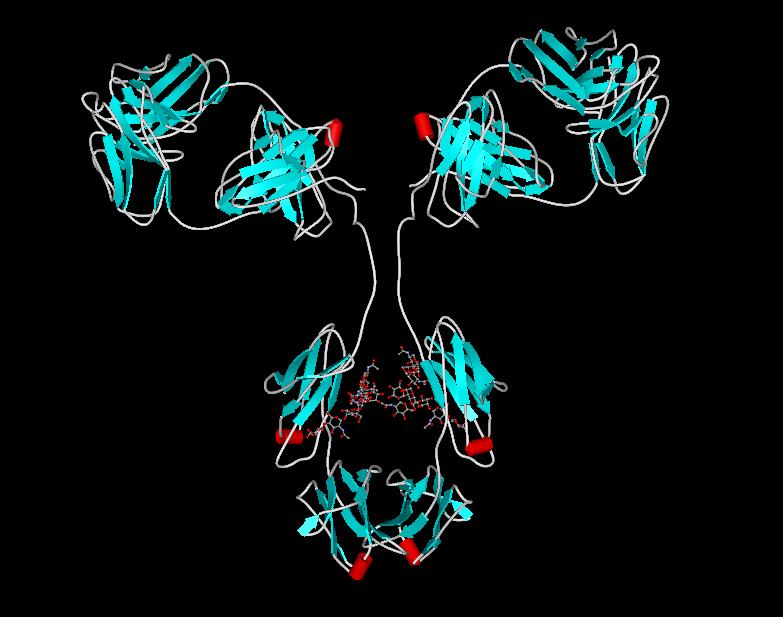
Human IgG1 model generated using Quanta and Charmm The model has been prepared using coordinates for a Fab fragment and an Fc fragment of human IgG1 available in the Brookhaven Protein data bank. The missing residues of the hinge region have been inserted and some attempt has been made at energy minimisation of the structure. The model has been created to use as a demonstration of various structural features which may be relevant to human IgG structure and function. This structure is being made available as an educational resource by Mike Clark,PhD of the Department of Pathology Cambridge University, Tennis Court Road, Cambridge CB2 1QP
Sottoclassi
IgG: Le quattro diverse sub-classi di IgG umane hanno catene H differenti note come catene gamma γ1,2,3 e 4. Differiscono nel numero e posizionamento dei ponti disolfuro, la precisa grandezza ed il numero di amminoacidi che le compongono.
Le IgG sono le immunoglobuline più abbondanti nel siero, ca. 75% delle immunoglobuline totali. Appaiono più tardi nella risposta immunitaria primaria (prima esposizione ad un particolare patogene) e sono prodotte in grosse quantità nella risposta immunitaria secondaria (successive esposizioni a quel patogene). L'abbondanza relativa delle sub-classi è: 1gG1 > IgG2 > igG3 >IgG4.
Per quanto riguarda alcune caratteristiche di ciascuna sub-classe, le IgG2 attraversano la placenta molto lentamente e dunque hanno una limitata abilità di essere trasmesse da madre a feto. L'abilità di attivare il complemento varia nell'ordine 1gG3 > IgG1 > igG2 >IgG4 (che è inattiva in questo rispetto). Le IgG1 e 3 hanno parti Fc che legano molto bene a recettori su cellule fagocitarie. IgG2 e 4 non legano altrettanto bene. Mentre le IgG3 hanno una vita molto breve nel siero, per le altre, questa è di una a tre settimane.
IgM: Queste sono le prime immunoglobuline ad apparire nella risposta immunitaria primaria. Sono meno abbondanti di IgG e IgA. Sui linfociti B non stimolati (naive) sono presenti come monomeri di ca 180 kDa. Nel siero, si trovano invece come pentameri di ca. 900 kDa, anche se l'unità di base è simile a quella degli IgG. Queste sono tenute insieme nel pentamero da ponti disolfuro. Ogni unità di base è composta da 2 catene L identiche (κ o λ) e due catene pesanti identiche (denotate catene mu μ). Differiscono dalle catene H delle IgG (cioè le catene γ) per avere un dominio costante in più, per non avere la regione della cerniera, e per essere più ricche in carboidrati (oligosaccaridi).
La funzione delle IgM è quella di legare antigeni (epitopi) con elevata avidità. Possono legare molte molecole di antigene contemporaneamente (fino a 10), portando a reticolazioni che permettono una più veloce rimozione. Inoltre, il pentamero IgM è un attivatore molto efficiente del sistema del complemento che è un elemento essenziale del sistema immunitario nei meccanismi di difesa umorale contro gli agenti infettivi.
IgA: Sono le immunoglobuline più abbondanti dopo le IgG, ma si concentrano soprattutto in fluidi secreti (mucose, saliva, lacrime, latte). Sono composte da due catene L, identiche e due catene H identiche. Possono esistere come monomeri (ca 160 kDa) oppure come multimeri. Nel siero oltre il 75% è monomerico, ma nei fluidi secreti (IgA secretorie) sono dimeri (ca. 385 kDa), con alcuni trimeri e tetrameri. Hanno una catena extra nota come pezzo secretorio, che proviene da un recettore epiteliale per anticorpi. Questo causa l'internalizzazione di IgA dimeriche nelle cellule, dalle quali sono poi secrete nell'ambiente esterno. La presenza del pezzo secretorio aumenta anche la resistenza di IgA alla degradazione proteolitica.
IgE: Le immunoglobuline E sono solo presenti in piccolissime quantità. La loro principale funzione è la difesa contro parassiti (es. vermi) ma sono anche note quali mediatrici di certe allergie.
Hanno la stessa struttura di IgG, ma la catena H (denotata epsilon ε) è più grande, e con più oligosaccaride, quindi il peso globale è di ca. 190 kDa. Non hanno la regione cerniera, e quindi sono meno flessibili di IgG. La Parte Fc della molecola trova recettori nei basofili e mastcellule. Quanto un antigene lega un IgE alle mastcellule, queste degranulano, rilasciando istamina ed altre sostanze. Queste forse servono per danneggiare i parassiti, ma, nel caso di allergie, causano effetti indesiderati.
Le IgE hanno una vita piuttosto breve nel siero (ca 2 giorni), ma potrebbero avere una vita più lunga se legate a mastcellule.
IgD: Con grandezza di 190 kDa, sono monomeri e poco abbondanti. Hanno una struttura simile alle IgG ma senza legami disolfuro fra le catene pesanti. La loro funzione non è ben nota, ma si ritiene che sono importanti per l'attivazione delle cellule B. Le IgD hanno la funzione di rimanere adese alla membrana plasmatica del linfocita e di permettere la sua attivazione una volta che siano venute a contatto con l'antigene per il quale sono specifiche. Pertanto, sono presenti principalmente in una forma associata alle membrane dei linfociti. Per questo motivo, sono poco presenti nel plasma.
Complesso maggiore di istocompatibilità (MHC)
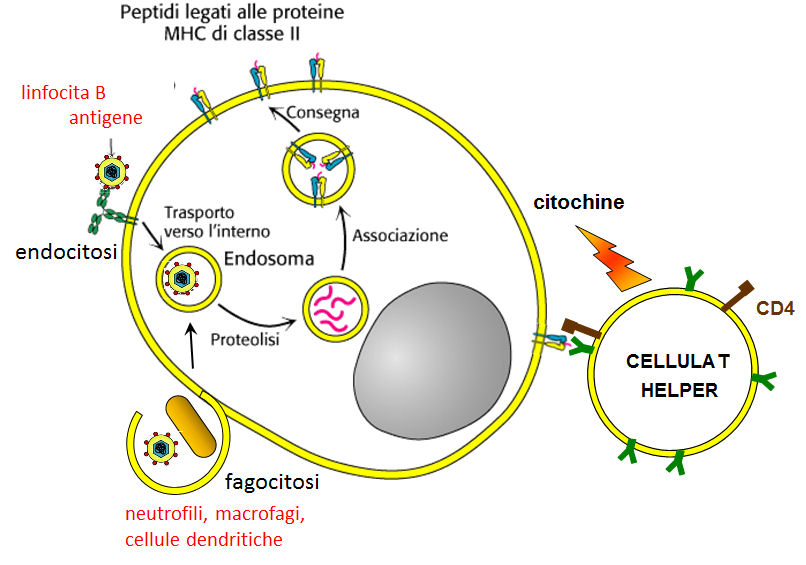
Le proteine del complesso maggiore di istocompatibilità (in inglese, Major Histocompatibility Complex MHC) in cellule tissutali nucleate infettate, legano molecole tipiche del patogeno e le espongono sulla membrana. Prendono così funzione di antigeni che rendono visibili i contenuti delle cellule infette ai recettori presenti sui linfociti T.
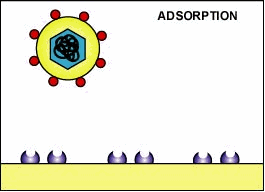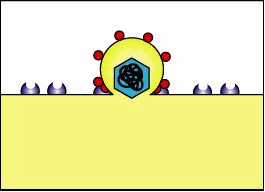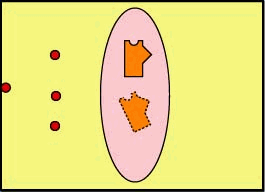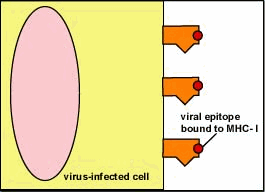
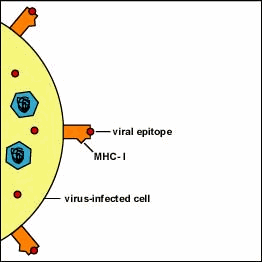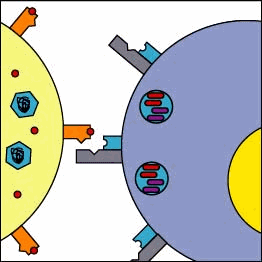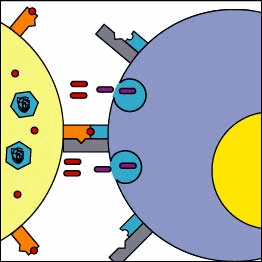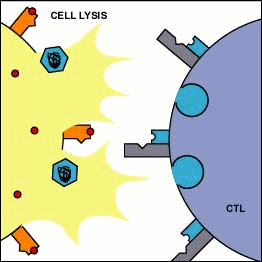
I complessi MHC-I (di classe I) sono piattaforme proteiche che presentano in continuazione, sulla superficie delle cellule, frammenti di proteine cellulari senescenti che sono degradate nei proteasomi in frammenti di lunghezza attorno ai 9 residui. Questi frammenti sono traslocati nel reticolo endoplasmatico dove si legano ad uno specifici sito sulle MHC. Queste proteine poi sono inviate alla membrana citoplasmatica in vescicole, e quando esposte sulla superficie, presentano i frammenti legati ai linfociti T-killer.
Se la cellula non è infetta, i frammenti provengono solo da proteine endogene che anno parte del self; quindi non inducono una risposta immunitaria. Se però la cellula è infetta, fra i frammenti di materiale self, saranno presenti anche frammenti di materiale non self, provenienti dal patogeno intracellulare. Questi frammenti non self inducono una risposta immunitaria se riconosciuti da linfociti T-killer, che si attivano ed uccidono la cellula, così neutralizzando l'infezione.

Le MHC di classe I presentano frammenti di proteine citoplasmatiche sulla superficie delle cellule (meccanismo “taglia ed esponi”), incluso frammenti di eventuali patogeni intracellulari. L'MHC presenta un frammento antigenico che può essere riconosciuto da linfociti T killer. Questi però devono anche riconoscere altre parti di MHC, anche con l'ausilio dei co-recettori CD8 (caratteristici delle cellule T killer). Quanto si forma il complesso MHC-antigene-cellula T-killer-CD8, la cellula T killer si attiva e scatta una sequenza di eventi che portano al rilascio di proteine, enzimi ed altre specie citotossiche che permeabilizzano la membrana della cellula infetta e ne causano la morte.
Gli MHCI però sono di per se stessi antigeni e direttamente implicati nel fenomeno del rigetto. Nell'uomo sono noti come Human leukocyte antigen (HLA). Quelli presenti sulle cellule endogene non inducono una risposta immunitaria, in quanto componenti del self. Se le proteine MHC presenti su cellule provenienti da tessuto trapiantato (esogeno) vengono a contatto col sistema immunitario, essendo non-self generano invece una forte risposta immunitaria, poiché riconosciute come estranee. Il sistema dell'HLA è quindi alla base del rigetto nel trapianto. Per questa ragione, prima delle operazioni si accerta che il donatore e ricevente siano HLA-compatibili mediante di un procedimento detto di tipizzazione tissutale.
- Ogni molecola MHC contiene un dominio tipo piattaforma posta nella porzione extracellulare, associata ad una coppia di domini Ig legati ad un dominio transmembrana.
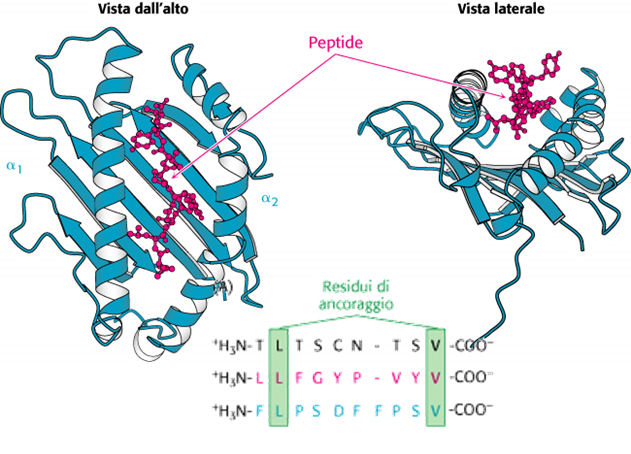
- Una tasca sulla piattaforma, costituita da due α-eliche appoggiate a mò di staccionate su un β-foglietto costituito da 8 filamenti. Questi presentano amminoacidi polimorfici che determinano la selettività del MHC per quanto riguarda i frammenti che lega.
- I domini Ig contengono il sito di legame per i recettori dei linfociti T:
- linfociti T killer CD8+ riconoscono solo le MHC di classe I
- in ogni caso, solo il legame al complesso peptide-MHC (e non solo al frammento peptidico antigenico) fa innescare la risposta immunitaria. Questo è detto "fenomeno della restrizione MHC" e fu scoperto per la prima volta da Rolf Zinkernagel e Peter Doherty in una serie di studi nel 1974.
MHC di classe I
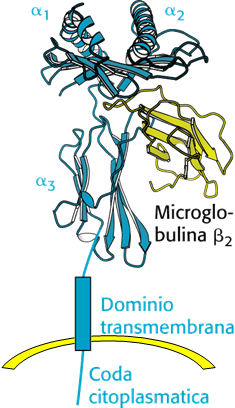
Le molecole MHC di classe I sono costituite da 2 catene legate non covalentemente: 
la catena α, ancorata alla membrana e la catena β2-microglobulina.
La tasca per il legame del peptide è contenuto nella catena α. Il complesso è completo solo con il legame del peptide che stabilizza le due catene e ne permette l'espressione sulla superficie cellulare.
MHC di classe I
Le molecole MHC di classe II sono costituite da 2 catene legate non covalentemente: 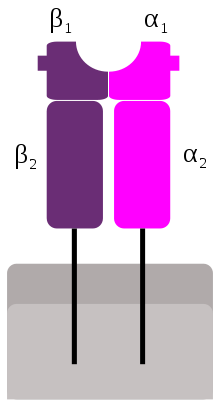
la catena α e la catena β sono entrambe ancorate alla membrana e rispettivamente
costituite da domini α1/α2 e β1/β2 , esi associano per formare un eterodimero.
La tasca per il legame del peptide è formato dai domini α1 e β1.
La piattaforme per il legame dell'antigene è più aperta ad entrambe le estremità che negli MHC I
e pertanto i peptidi che si possono legare a MHC II possono essere più lunghi (15-24 residui) che
quelli che si legano a MHC I (ca. 8-10 residui)
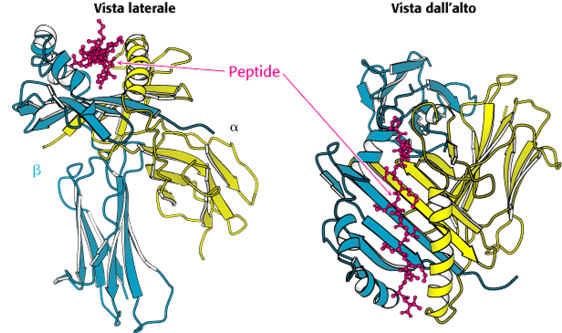
Le MHC II sono formate da due catene (α eβ), ciascuna con due domini extracellulari, uno transmembrana ed uno intracellulare. Il sito di legame per l’antigene è una piattaforma recintata, formata da un β-foglietto (formato da β-filamenti provenienti da entrambe le catene α eβ, e 2 α-eliche, ciascuna proveniente da una catena. Peptidi di 15-24 residui si legano in forma estesa, ancorati da residui alle estremità del sito di legame.
Materiale aggiuntivo
Riconoscimento di antigeni da parte di linfociti B, attivazione e formazione di Ig
MHC-I e la presentazione dell’antigene in cellule infette e attivazione di linfociti T-killer
MHC-II e la presentazione dell’antigene in cellule infette e attivazione di linfociti T-killer
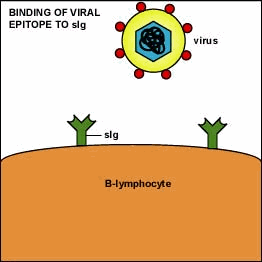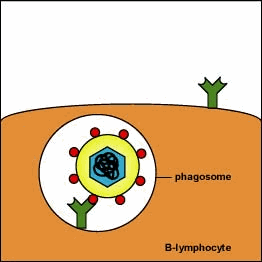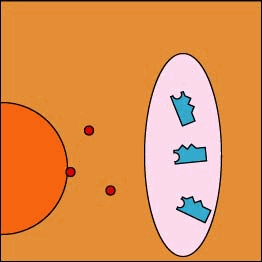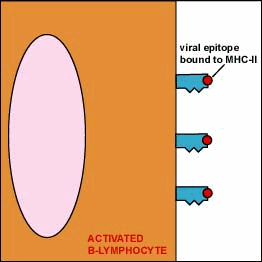
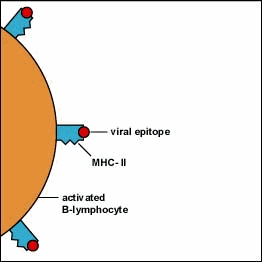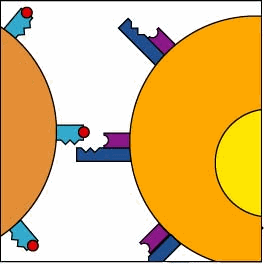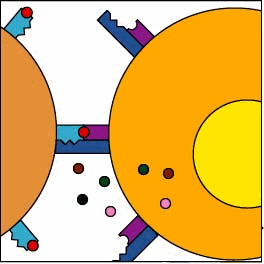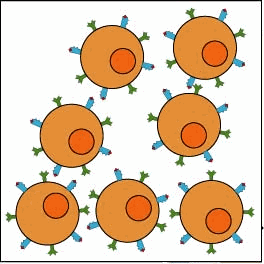
MHC-II e la presentazione dell’antigene in Cellule presentanti l’antigene (APC)
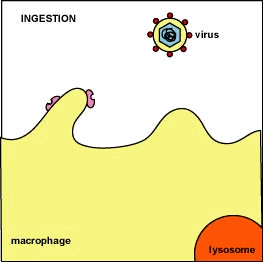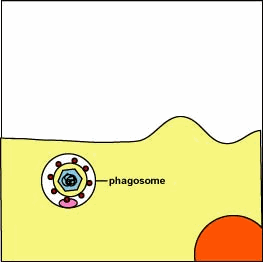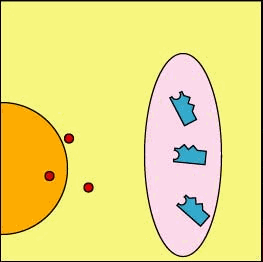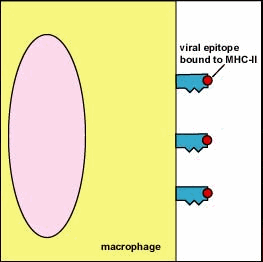
Glossario
Antigene: macromolecola capace di reagire con i prodotti del sistema immunitario
Determinante antigenico: Piccola parte di un antigene (detto anche epitopo) che lega un anticorpo specifico. Una singolo antigene può contenere molti epitopi simili riconosciuti da un particolare anticorpo, oppure anche molti epitopi differenti riconosciuti da anticorpi diversi.
Antigenicità: capacità dell'antigene di combinarsi specificamente con un anticorpo. Per attivare i lionfociti B, un antigene deve avere una certa dimensione, per essere riconosciuto dai linfociti. Per questa ragione, piccoli epitopi possono essere molto antigenici ma poco immunogenici.
Immunogenicità: capacità dell'antigene di indurre una risposta immunitaria. In genere, per aumentare l'immunogenicità di un epitopo è necessario conjugarlo con un sistema carrier di più grandi dimensioni (es. una proteina come l'albumina),e somministralo assieme ad una sostanza adjuvante (es. olio minerale)
Aptene: piccola molecola (<10 kDa) antigenica ma non immunogena. Diventa immunogena se legata a macromolecola carrier.
Adiuvante: sostanza in grado di stimolare e aumentare la risposta ad un antigene, senza manifestare essa stessa proprietà antigeniche.
Anticorpi policlonali: miscela di anticorpi diversi fra loro, ottenuti dall’ immunizzazione di un animale con un antigene che contiene diversi tipi di epitopi.
Anticorpi monoclonali (mAB): anticorpi identici fra loro prodotti da linee cellulari provenienti da un diverso clone di cellule B. (isolate specificatamente). I linfociti B sono immortalizzati (convertiti in una linea cellulare che può essere coltivata) fondendoli con cellule trasformate (ibridomi).
