Dicroismo circolare
Spettroscopia in Dicroismo Circolare
- Sommario
- Introduzione
- Teoria del CD
- Strumentazione
- Preparazione e misurazione dei campioni
- Aquisizione dei dati
La spettroscopia di dicroismo circolare si usa per ottenere informazioni riguardanti la struttura secondaria di proteine e polipeptidi in soluzione.
Vantaggi :
- bassa quantità di campioni richiesta (200ml di soluzione 0.5 mg/ml in acqua o tampone ),
- tecnica non-distruttiva (si può recuperare il materiale).
- si possono osservare effetti di ambienti diversi sulla struttura (pH, agenti caotropici denaturanti, soventi organici , temperatura,....)
- interferenza da parte dell'ambiente se costituito da solventi che assorbono nella regione dell'UV
- misure possibili solo con campioni molto diluiti.
- fornisce informazioni qualitativi sul contenuto di struttura 2°, ma non dove si trova nella struttura 3°.
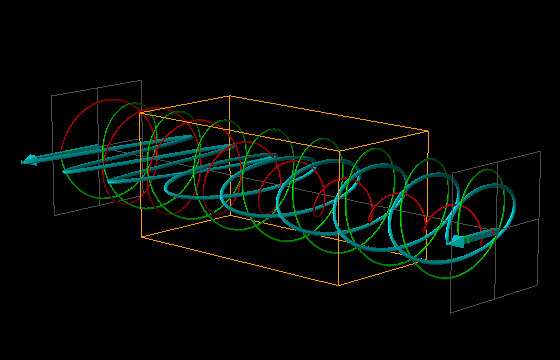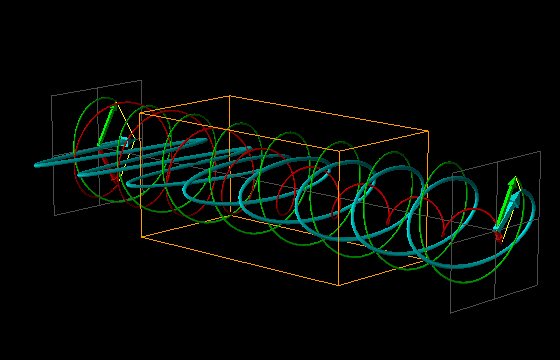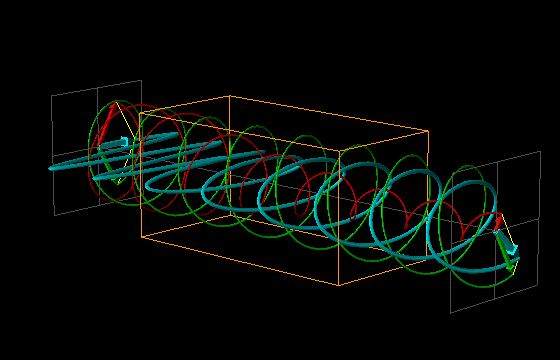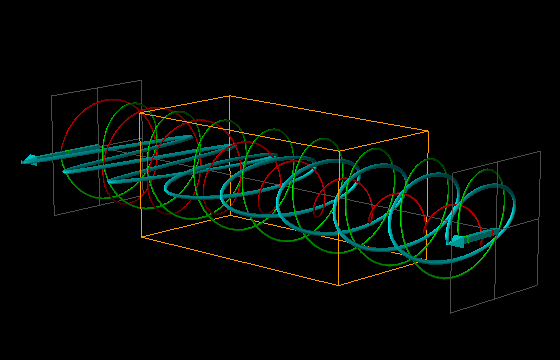
L'effetto di dicroismo circolare (CD) si osserva quando molecole otticamente attive assorbono diversamente la luce circolarmente polarizzata destra e sinistra.
Viene misurato con un spettropolarimetro CD, uno strumento che comunemente misura accuratamente l'assorbimento di soluzioni da lunghezze d'onda che variano dai 190 fino a 600 nm. Gli spettri CD di diversi tipi di strutture secondarie presenti in un polipeptide sono molto different fra di loro. Quindi l'analisi dei loro spettri CD può dare informazioni utili sul tipo di strutture secondarie presenti nelle macromolecole biologiche.
La luce linearmente polarizzata può essere vettorialmente scomposta in luce circolarmente polarizzata a destra e luce circolarmente polarizzata a sinistra, uguali in intensità e lunghezza d'onda.
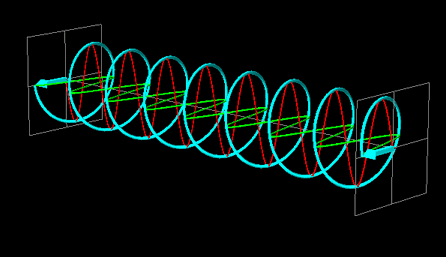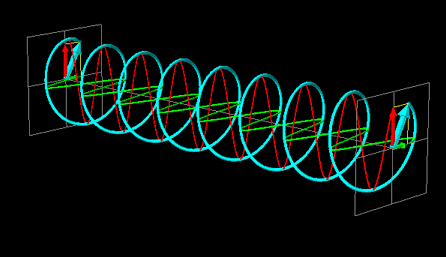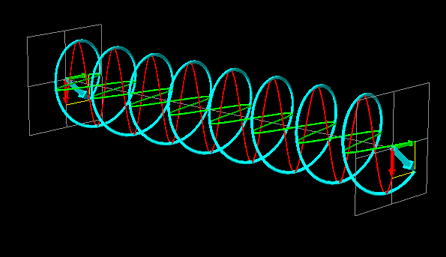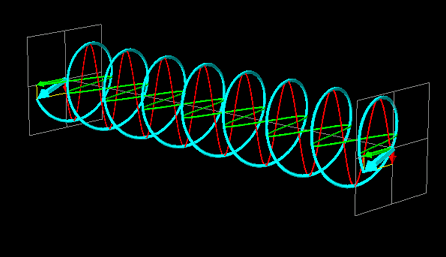
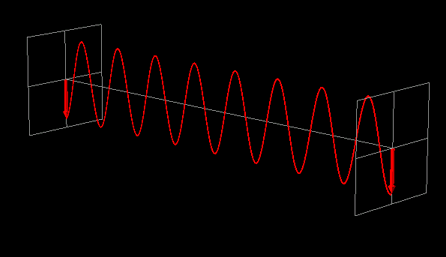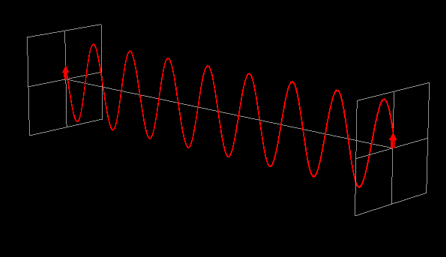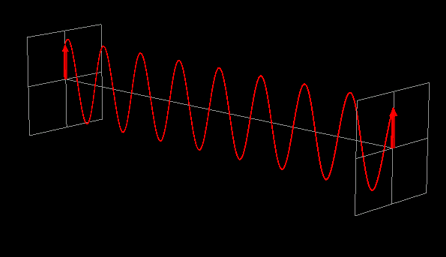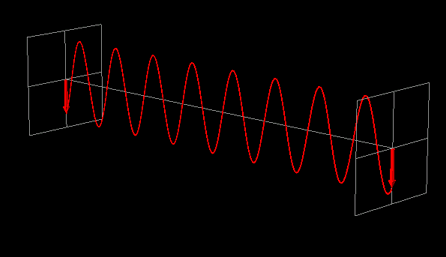
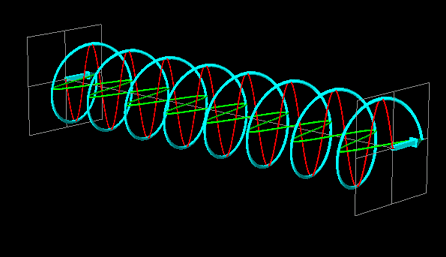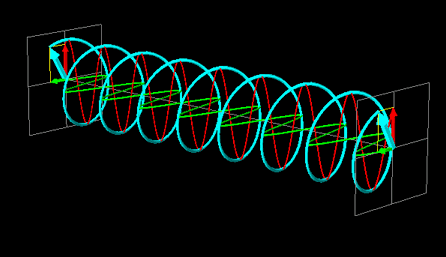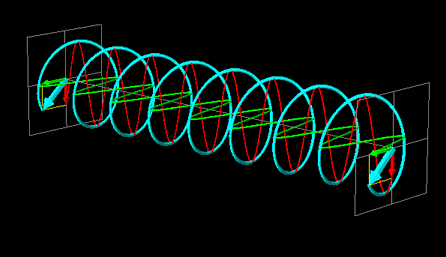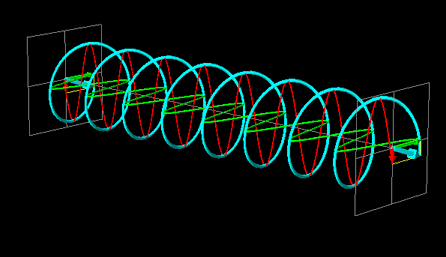
Se la luce linearmente polarizzata, scomposta in componenti circolarmente polarizzate a destra e sinistra passa attraverso una soluzione di sostanza otticamente attiva, uno dei due componenti circolarmente polarizzato subisce un assorbimento maggiore dell'altro. Ciò significa che i due componenti non hanno più la stessa intensità e quindi non si ricompongono per formare luce linearmente polarizzata, ma piuttosto luce elitticamente polarizzata. Il manifestarsi di questa luce ellitticamente polarizzata viene chiamata Dicroismo Circolare che è diverso dalla rotazione ottica.
I più comuni sono quelli prodotti dalla JASCO, Jobin Yvon, OLIS, and AVIV . Il dipartimento di Scienze chimiche dispone di un modello Jasco J600.
Preparazione dei campioni e misurazioni
- Additivi, tamponi e agenti stabilizzanti: Generalmente i polipeptidi vengono disciolti in tampone fosfato a 5 mM, sufficiente per mantenere il pH neutro ma con bassa assorbanza nell'UV. Qualunque composto nella soluzione che assorba nella regione 250 - 190 nm deve essere evitato poichè maschera il segnale
- Soluzione: Deve quindi contenere solo quei composti necessari alla stabilità delle molecole da analizzare (se necessari) e alla concentrazione più bassa possibile. Il composto da analizzare deve essere il più puro possibile.
- Misurazioni: Gli esperimenti iniziali servono per trovare le condizioni ottimali per l'esperimento reale. Cellette di quarzo di 0.2 - 0.5 mm sono un buon punto di partenza. Si eseguono per primi spettri dell'aria e del tampone senza il campione per controllo. Nel J600 Si osserva il segnale del voltaggio sul moltiplicatore. Questo aumenta se la soluzione assorbe per compensare alla perdità di luce trasmessa. Si deve evitare che il voltaggio salga al di sopra di 800V.
- Concentrazione del campione: deve essere nota con precisione e non superare i 0.5 mg/ml per i polipeptidi (20-40 µM)
- Setting dello strumento: da 190 -250nm per polipeptidi, scanzione di 0.5nm/s, band width 1 nm, accumulo di almeno tre scansioni
La differenza in assorbimento fra luce polarizzata a destra e sinistra è generalmente è molto bassa ma può essere accuratamente misurata.
Il parametro che viene misurato dallo strumento è θ che indica l'ellitticità. θ può essere derivato da una semplice equazione empirica dalla differenza di assorbimento della luce circolarmente polarizzata (cioè dalla differenza nei coefficenti di estinzione delle due componenti circolarmente polarizzate, Δε)
θ = 3300Δε
Lo strumento misura θ ad ogni lunghezza d'onda e produce un dicrogramma o spettro CD, dove sono plottati l'elitticità (in milli° o mdeg) contro la lunghezza d'onda (λ) in nm. Siccome ad alcune lunghezze d'onda viene assorbita più la luce polarizzata circolarmente a sinistra di quella a destra, ma ad altre vice versa, θ può avere valori positivi o negativi.
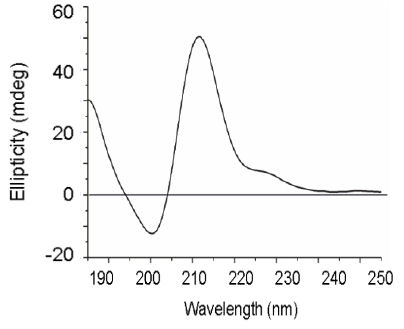
Per quanto riguarda i polipeptidi, mostrano degli spettri CD caratteristici per i diversi tipi di struttura 2a. Ricercatori sono riusciti ad ottenere spettri di base per strutture 2e "pure" (cioè specifiche per la struttura):
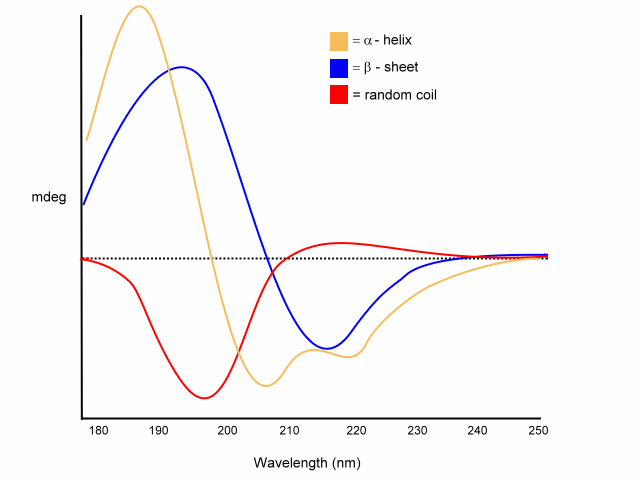
Gli spettri delle proteine sono composti dalla somma ponderata di tutti i contributi derivanti dai diversi elementi di struttura secondaria che sono presenti e la loro relativa abbondanza. Da questi spettri, conoscendo gli spettri di base, è possibile la deconvoluzione dello spettro reale nei suoi componenti, e quindi stimare la percentuale di ogni tipo di struttura presente nella proteina. Qui sotto ci sono esempi di spettri CD per quattro proteine con diversi contenuti in α-elica, β-foglietto e turn.
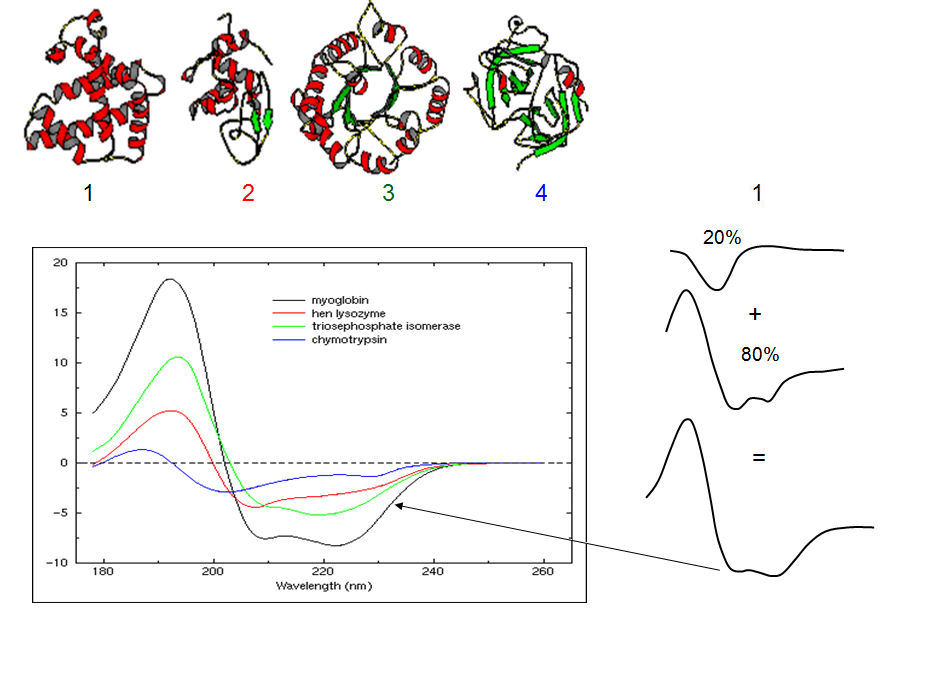
1. myoglobin (α-elica :80% ,β-foglietto : 0% , turn: 10%, random coil: 10%);
2. hen egg lysozyme (α-elica : 35% ,β-foglietto :10%, turn: 30%, r. coil: 25%);ù
3. triosephosphate isomerase (α-elica :50%, β-foglietto 15%, turn:10%, r. coil: 25%);
4. chymotrypsin (α-elica :10%, β-foglietto: 35%, turn: 20%, r. coil:35%).
