E.1 Esercizi sui Sistemi TD e I PTD 31/03/2025 (16:00 - 18:00)
Aggregazione dei criteri
- Es. 1 - 200 g di ghiaccio a 0 C vengono posti in 500 g di acqua a 20 C dentro un contenitore adiabatco. Trascurando gli scambi con l'aria all'interno del recipiente, determinare le condizioni finali di equilibrio del sistema. Se invece di 500 g d'acqua avessi avuto 1 kg, quale sarebbe stato il risultato finale? (suggerimento: andate a vedere quanto vale il calore latente di fusione dell'acqua ed il calore specifico dell'acqua)
- Es. 2 - Due moli di gas perfetto
inizialmente a p_A=3 atm, occupano un volume V_A = 50 litri, e compiono
il ciclo ABCDA, composto di trasformazioni quasi statiche. AB:
espansione isoterma raddoppia il volume iniziale, BC: isocora fino alla
pressione di 1 atm, CD: compressione isoterma fino alla pressione
iniziale, DA: espansione isobara a chiudere il ciclo. (suggerimento:
fate BENE il disegno del ciclo, ed avrete risolto meta' dell'esercizio,
inoltre fate bene attenzione che io non vi ho detto se il gas e'
monoatomico o biatomico). Calcolare il calore totale scambiato durante il ciclo.
- Es. 3 - In un recipiente sono contenute una mole di gas perfetto monoatomico ed una mole di gas perfetto biatomico. La pressione all'interno del recipiente è di 2 atm e la temperatura è 300 K. Attraverso una trasformazione adiabatica reversibile il recipiente viene compresso fino a metà del volume iniziale. Calcolare il lavoro compiuto sul sistema
- Es. 4 - Un
recipiente cilindrico, con l'asse disposto verticalmente, chiuso
superiormente da un pistone di massa m = 10 kg e sezione S = 20 cm
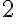 ,
scorrevole senza attrito lungo l'asse del cilindro, contiene n = 0.1 mol
di un gas perfetto monoatomico alla pressione p_0 e temperatura T_0 =
300 K, in equilibrio termodinamico con l'ambiente esterno dove l'aria è a
pressione atmosferica. Si agisce sul pistone con una forza esterna F di
intensità opportunamente variabile, facendolo abbassare fino a ridurre
il volume del gas al valore
,
scorrevole senza attrito lungo l'asse del cilindro, contiene n = 0.1 mol
di un gas perfetto monoatomico alla pressione p_0 e temperatura T_0 =
300 K, in equilibrio termodinamico con l'ambiente esterno dove l'aria è a
pressione atmosferica. Si agisce sul pistone con una forza esterna F di
intensità opportunamente variabile, facendolo abbassare fino a ridurre
il volume del gas al valore 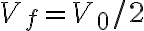 . Il lavoro compiuto dall'insieme
della forza F applicata e dalla pressione esterena è L = 200 J, la
pressione finale raggiunta dal gas è
. Il lavoro compiuto dall'insieme
della forza F applicata e dalla pressione esterena è L = 200 J, la
pressione finale raggiunta dal gas è 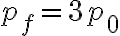 . Si calcoli la quantità
di calore scambiato dal gas con l'esterno e si stabilisca se alla fine
di questa trasformazione il sistema possa essere considerato in
equilibrio termodinamico con l'esterno.
. Si calcoli la quantità
di calore scambiato dal gas con l'esterno e si stabilisca se alla fine
di questa trasformazione il sistema possa essere considerato in
equilibrio termodinamico con l'esterno. - Es. 5 - Una mole di gas
perfetto, inizialmente alla pressione
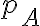 = 1 atm,
= 1 atm, 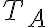 = 300 K viene
compresso isotermicamente fino a
= 300 K viene
compresso isotermicamente fino a 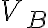 =
= 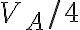 , successivamente il gas
compie una espansione adiabatica fino a
, successivamente il gas
compie una espansione adiabatica fino a 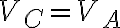 e
e 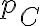 = 0.4 atm.
Determinare la variazione di Energia Interna del sistema alla fine delle
due trasformazioni e determinare di che tipo di gas si tratta.
= 0.4 atm.
Determinare la variazione di Energia Interna del sistema alla fine delle
due trasformazioni e determinare di che tipo di gas si tratta. - Es. 6 - Un recipiente cilindrico di base circolare con r=10 cm di lunghezza ed altezza h = 1 metro, è diviso in tre volumi da due setti diatermici, di spessore e massa trascurabile, mobili senza attrito. Nel primo volume vi è una massa m_1 = 4 g di O_2 (peso molecolare 32 g/mol), nel secondo volume una massa m_2 = 7 g di N_2 (peso molecolare 28 g/mol) e nel terzo volume una massa m_3 = 14 g di aria, considerata come gas perfetto biatomico con peso molecolare 29 g/mol. Determinare nelle condizioni di equilibrio a T = 300 K, le pressioni a cui si trovano i tre gas. (suggerimento: ricordatevi che i sistemi termodinamici in contatto attraverso pareti diatermiche, dopo un tempo sufficientemente lungo raggiungono l'equilibrio termico, e se le pareti sono mobili, anche l'equilibrio termodinamico)
- Es. 7 - Una mole di gas perfetto si espande seguendo la trasformazione politropica pV^3 = k, raddoppiando il volume iniziale. Determinare il rapporto fra la temperatura iniziale e finale, ed il lavoro compiuto in funzione dei parametri iniziali.
Soluzioni esercizi (link)
Ultime modifiche: mercoledì, 5 marzo 2025, 09:07
