346ME - TECNICHE DI SCREENING DEI TUMORI AL COLLO DELL'UTERO 2019
Schema della sezione
-
INTRODUZIONE
Il carcinoma del collo CC dell’utero rappresenta ancora oggi una patologia assai rilevante dal punto di vista sanitario e sociale; infatti vengono diagnosticati ogni anno nel mondo circa 569.847 nuovi casi e di questi l'85% nei paesi in via di sviluppo , dove rappresenta quasi il 12% di tutti i tumori femminili (GLOBOCAN 2018 ) .
I dati dei registri nazionali tumori mostrano che, in Italia, l’incidenza e la mortalità del tumore della cervice dal 1980 al 2018 sono in continua riduzione. Nel 2018 sono stimati 2.400 nuovi casi (pari all’ 1,3% di tutti i tumori incidenti nelle donne). Questa neoplasia è più frequente nella fascia giovanile (4% dei casi, quinta neoplasia più frequente) mentre dopo i 50 anni rappresenta complessivamente l’1% dei tumori femminili. (AIRTUM, I numeri del cancro in Italia 2018).
Il fattore eziologico di questa neoplasia è rappresentato quasi esclusivamente da un pool di ceppi ad alto rischio del Papilloma virus umano HPV . La cancerogenesi è di lunga durata e il carcinoma rappresenta la fase evolutiva finale di una serie di lesioni a rischio progressivamente più alto, che particolarmente nelle fasi iniziali possono peraltro regredire spontaneamente. La lunga fase preclinica della malattia e la possibilità di asportare le lesioni precancerose che ne caratterizzano la progressione costituiscono i punti di forza dei programmi di screening.
La diagnosi precoce con l'utilizzo del Pap-Test rappresenta l’arma più efficace nella prevenzione del carcinoma della cervice uterina. In Italia la diffusione del Pap-test a livello spontaneo, a partire dagli anni ’60 e, soprattutto, l’avvio dei programmi di screening organizzato hanno rappresentato i principali fattori di riduzione dell’incidenza e ancor più della mortalità per questa neoplasia. I programmi di screening regionali hanno invitato nel 2015 il 76% delle donne in età 25-64 anni. Il Piano Nazionale Prevenzione 2014-2018 ha dato indicazione a tutte le Regioni di introdurre il test molecolare HPV in sostituzione del Pap-Test come test di primo livello nello screening cervicale entro il 2018 perchè molto più sensibile e automatizzabile. Il test molecolare ricerca sequenze di DNA dei virus HPV ad alto rischio oncogeno. Esiste ormai una chiara evidenza scientifica che uno screening primario con test clinicamente validati per il DNA di HPV oncogeni e con un protocollo appropriato è più efficace dello screening basato sul Pap-Test nel prevenire i tumori invasivi del collo dell’utero La grande maggioranza delle Regioni si sta organizzando, compresa il Friuli Venezia Giulia, nel sostituire il Pap-Test con il test molecolare HPV .
Bisogna tenere presente che l'introduzione del test molecolare richiede una fase preparatoria di riorganizzazione a livello regionale e che successivamente il passaggio non è immediato per tutte le donne di un’area ma diluito su 3-4 anni al fine di evitare sbalzi dell’attività dovuti al cambio di periodismo (da 3 a 5 anni).
L’adesione si mantiene intorno al 50%, lievemente superiore a quella generale all’invito allo screening. Tale dato deriva comunque anche dal fatto che la conversione non è avvenuta in Regioni dove l’adesione era più bassa.
La proporzione di donne positive al test è in aumento al Nord ed al Centro, si mantiene stabile al Sud, con una media italiana di circa l’8%.
I PROGRAMMI DI SCREENING
I programmi di screening possono essere attuati attraverso:
· Prevenzione primaria-vaccinazione
· Prevenzione secondaria-Pap test, Citologia su strato sottile e HPV test
La prevenzione primaria prevede interventi atti a mutare abitudini sociali, a migliorare lo stato sanitario e culturale delle donne unitamente all’impiego di tutte le misure idonee ad evitare o ridurre l’infezione mediante estesi programmi di vaccinazione.
La vaccinazione ha come obiettivo direttamente l’agente eziologico che causa sia le lesioni pretumorali che il CC, per questo motivo si sono sviluppate intense ricerche per produrre vaccini profilattici contro specifici ceppi di HPV (HARPERT LANCET 2004).
In Italia, a partire dall'anno 2007, è stata pianificata una strategia di vaccinazione pubblica contro l’ HPV per tutte le ragazze al compimento del dodicesimo anno d’ età in quanto il meccanismo di azione del vaccino è legato alla neutralizzazione del virus quando è ancora libero in vagina, e per questo è inefficace nelle donne che sono già state infettate (EPICENTRO).
Il vaccino non sostituirà lo screening, ma questo dovrà essere modificato. Il vaccino inoltre offrirà l’ opportunità di raggiungere più facilmente fasce della popolazione restie a partecipare e fidelizzarsi a un programma di screening e anche questo è un elemento importante perché la maggior parte dei CC si verifica in donne che non si sottopongono a Pap test.
La prevenzione secondaria comprende il Pap test, la Citologia in fase liquida o su strato sottile(LBC) e la ricerca del virus HPV (HPV tests)
Gli obiettivi della prevenzione secondaria richiedono invece misure clinico-terapeutiche volte ad attuare:
· la diagnosi della malattia nelle sue fasi precoci
· una maggiore efficacia degli interventi terapeutici
Il Pap test è il primo test di screening per il cancro al collo dell’ utero più comunemente conosciuto come striscio vaginale ampiamente utilizzato per più di 60 anni e mantenuto praticamente inalterato fino ad oggi . Il Pap test si effettua nel corso di una normale visita ginecologica, durante la quale si applica lo speculum, uno speciale strumento che dilata leggermente l'apertura vaginale in modo da favorire il prelievo. L'operatore inserisce poi delicatamente una speciale spatola (spatola di Ayre) e uno spazzolino (Cytobrush) per raccogliere piccole quantità di cellule rispettivamente dal collo dell'utero e dal canale cervicale. Le cellule esfoliate e prelevate vengono strisciate su un vetrino, fissate e colorate con la colorazione di Papanicolaou .
I motivi che hanno permesso il sempre maggior successo di questa metodica sono essenzialmente :
La scoperta nel 1975 che alcune modificazioni morfologiche cellulari (coilocitosi) erano legate alla presenza di un’ infezione virale da HPV.
· Il consenso ottenuto nel 1988 e nel 2001 su un sistema di refertazione in grado di rendere più omogenea e riproducibile l’interpretazione citologica e stabilire un univoco percorso di approfondimento diagnostico .
Attualmente il sistema maggiormente utilizzato per la refertazione citologica è il sistema Bethesda 2001.
La citologia in fase liquida è stato introdotta a metà degli anni Novanta e permette di ottenere un preparato di alta qualità in monostrato (strato sottile) senza interferenze, cioè un preparato libero da sangue e muco e da strati di materiale sovrapposto con pochi elementi infiammatori che talvolta ostacolano una corretta interpretazione offrendo una sensibilità maggiore rispetto al Pap test convenzionale, una minor percentuale di inadeguati e una maggiore riproducibilità interpretativa tra operatori
Sono state utilizzate numerose e differenti tecniche di citologia in fase liquida: fra queste, ThinPrep® e Surepath® hanno ricevuto l’approvazione Food and Drug Administration (FDA) e risultano ampiamente le metodiche più utilizzate. Il test è molto semplice e richiede il prelievo con uno spazzolino di un campione di cellule del collo dell’utero esattamente nello stesso modo del Pap test, lo strumento poi viene agitato in un barattolino contenente una sostanza conservante. L’allestimento del vetrino avviene in maniera automatica utilizzando uno strumento con il quale le cellule in sospensione vengono raccolte tramite aspirazione o sedimentazione sulla superficie di una membrana e poi trasferite su vetrino.
L’introduzione della citologia in fase liquida ha inoltre il vantaggio di consentire l’ applicazione di metodiche molecolari per la ricerca del virus HPV e di marcatori di progressione con tecniche di immunocitochimica sullo stesso campione. In questa prospettiva, grande attenzione nella scelta del sistema per la citologia in fase liquida deve essere posta alle caratteristiche del liquido conservante, che deve essere in grado di mantenere la stabilità del DNA a temperatura ambiente per un minimo di 30 giorni e permettere valutazioni su RNA.
Il Test HPV I progressi delle tecniche diagnostiche, in particolare la messa a punto di test genetici molecolari di facile impiego, stanno sostituendo l’utilizzo del consolidato Pap test come strumento di screening. Il Test HPV si esegue sempre su un piccolo campione di cellule prelevate dal collo dell’utero, come il Pap test , però non è un esame morfologico ma un esame di biologia molecolare che permette di rilevare la presenza del virus HPV mediante l’individuazione del suo DNA o RNA messaggero. I risultati di numerosi studi sperimentali dimostrano una maggiore sensibilità del test rispetto al tradizionale Pap test a scapito però di una minore specificità dovuto a due fattori principali :
· Il test HPV si basa sulla ricerca di 12-14 tipi di virus che hanno un maggiore potenziale oncogeno
· Il test HPV non discrimina tra infezioni transitorie e infezioni persistenti e produttive
I test molecolari più utilizzati si basano sulla ricerca di sequenze virali di HPV e tipizzazione dei genotipi utilizzando tecniche di biologia molecolare, quali l’ibridazione diretta, la PCR qualitativa e il sequenziamento nucleotidico virale.
L’ibridazione diretta o Hybrid Capture è un metodo non radioattivo, accurato e riproducibile con una sensibilità ben convalidata, ed è l’unico approvato dalla FDA. È un test di ibridazione molecolare in fase liquida e cattura su micropiastra delle cellule di sfaldamento della cervice uterina. Il test è capace di determinare concentrazioni molto basse di DNA e può essere utilizzato per determinare sia gli HPV a basso rischio (6, 11, 42, 43, 44) che gli HPV ad alto ed intermedio rischio oncogeno (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, e 58). Non individua tuttavia il singolo tipo virale né la carica virale esatta che è calcolata in modo semiquantitativo tramite un gradiente di intensità di chemioluminescenza.
Il metodo consiste nella denaturazione del DNA in singolo filamento che viene ibridato in soluzione con probes mix a RNA: un probe evidenzia i tipi a basso rischio ed un altro evidenzia i virus ad alto rischio oncogeno. Ciascuna miscela di reazione, contenente gli ibridi RNA/DNA formatisi, viene trasferita in una provetta alle cui pareti sono adesi anticorpi policlonali rivolti contro gli ibridi RNA/DNA.
Gli ibridi legati vengono quindi fatti reagire con un anticorpo, diretto contro gli ibridi RNA/DNA, coniugato con fosfatasi alcalina. Il materiale non legato viene rimosso mediante lavaggi e quindi viene aggiunto substrato chemioluminescente che si lega alla fosfatasi alcalina. La luce prodotta dalla reazione viene misurata mediante un lumenometro in unità di luce relativa (RLUs).
La PCR real time Questa tecnica è un’implementazione della PCR classica e permette di avere informazioni quantitative più precise sulle concentrazioni relative al DNA amplificato. Per la PCR qualsiasi sequenza di acido nucleico, presente in un campione, può essere amplificata mediante un processo ciclico per generare un gran numero di copie identiche che possono essere successivamente analizzate. La reazione di PCR è caratterizzata da una serie di cicli a diverse temperature che permettono la denaturazione delle molecole di DNA target, l’ibridazione dei primers specifici e l’allungamento della catena ad opera della Taq polimerasi. Ogni ciclo si compone di tre tappe e può essere ripetuto 20-40 volte. Il modo più facile per identificare un prodotto di PCR è quello di monitorare di continuo l’andamento della reazione, senza dover interrompere la reazione per poterla visualizzare su gel. La real-time implica che la collezione dei dati e l’analisi avvenga contemporaneamente al procedere della reazione.
Il sequenziamento nucleotidico permette di ottenere la sequenza nucleotidica di una molecola di acido nucleico letti nel corretto ordine, definendo il tipo di HPV presente.
La tecnica più utilizzata, negli ultimi anni, è il pirosequenziamento. Questa tecnica permette il sequenziamento del DNA tramite sintesi. Il sistema di rilevamento è basato sul pirofosfato rilasciato quando un nucleotide è introdotto nel filamento di DNA, così il segnale può essere quantitativamente connesso al numero di basi aggiunte e rilevato in un pirogramma. Il genoma dei diversi tipi di virus HPV è diverso e quindi genera diversi tipi di pirogrammi la cui lettura consente di individuare l’esatto tipo di virus. Questa metodica non è di facile utilizzo non è automatizzabile ed è molto costosa -
Il Piano Regionale Prevenzione 2014-2018 nel macro obiettivo di “Ridurre il carico prevenibile ed evitabile di morbosità, mortalità e disabilità delle malattie non trasmissibili”, in coerenza con le indicazioni/raccomandazioni del Ministero della Salute, recependo gli indirizzi scientifici internazionali, indica tra gli obiettivi da perseguire: “Riorientare/avviare i programmi di screening per il cancro della cervice uterina introducendo il test HPV-DNA”.
Esiste infatti una chiara evidenza scientifica che uno screening con test clinicamente validati per il DNA di HPV oncogeni come test di screening primari e con un protocollo appropriato, è più efficace dello screening basato sulla citologia nel prevenire i tumori invasivi del collo dell’utero (“Test HPV validati per lo screening del carcinoma della cervice uterina”.).
Il Ministero della Salute ha emanato un Documento di indirizzo sull’utilizzo del HPV-DNA come test primario per lo screening del tumore del collo dell’utero, elaborato dal Direttivo dell’Osservatorio Nazionale Screening. Le raccomandazioni contenute nel documento derivano dalle evidenze scientifiche riportate nel Rapporto di Health Technology Assessment (HTA) Italiano “Ricerca del DNA di papilloma virus umano (HPV) come test primario per lo screening dei precursori del cancro del collo uterino”, in cui si raccomanda l’utilizzo del test HPV-DNA per lo screening primario, a condizione che vengano applicati protocolli appropriati.
Gli obiettivi del Piano Nazionale Prevenzione sono stati recepiti dalla Regione FVG, la quale, come riportato nel Piano Regionale di Prevenzione 2014-18, si propone come obiettivo centrale di riorientare l’attuale programma di screening per il cancro della cervice uterina introducendo il test HPV-DNA.
L’implementazione di un nuovo test di screening primario che sostituisca il collaudato Pap test in un programma organizzato deve essere preceduto, oltre che da solide prove di efficacia, anche da prove di fattibilità sul campo. In particolare bisogna valutare l’impatto sul servizio sanitario e sulle utenti. I principali aspetti da valutare sono:
- • l’impatto sull’organizzazione del servizio sanitario: logistica, software gestionali, ecc.;
- • l’accettabilità da parte dei professionisti, che si riflette nella congruenza con quanto previsto dai protocolli e ciò che viene effettivamente raccomandato alla donna in termini di intervalli fra i test e di approfondimenti necessari;
- • l’accettabilità da parte della popolazione sia del test che dei protocolli di gestione;
- • la valutazione dei costi e delle risorse assorbite e liberate dal cambiamento di test primario.
Tale cambio necessita di un percorso conoscitivo ed informativo specifico per tutte le figure professionali coinvolte in questo processo di screening: oltre alle conoscenze scientifiche alla base del cambiamento e allo studio del diagramma di flusso delle azioni previste dal nuovo protocollo di screening. E’ necessario armonizzare tra loro gli operatori che storicamente hanno vissuto una diversa gestione dell'attuale programma di screening:
- Diffondere la conoscenza scientifica su cui si basa la scelta del cambiamento di offerta di screening
- Diffondere la conoscenza del percorso di screening per garantire la omogeneizzazione su tutto il territorio ;
- Favorire la rete di conoscenze e di collaborazioni tra professionisti per aumentare la possibilità di una divulgazione univoca delle fasi del protocollo (sia nelle azioni che nelle tempistiche) presso la popolazione utente
Popolazione target, intervallo di screening e test da utilizzare
Lo screening cervicale è rivolto alle donne di età compresa tra i 25 e i 64 anni. Lo screening basato sul test HPV non deve iniziare prima dei 30 anni di età. Vi è evidenza, infatti, che sotto i 30 anni lo screening basato sul test HPV conduce a sovra-diagnosi di lesioni precancerose che sarebbero regredite spontaneamente, con il conseguente rischio di sovra-trattamento.
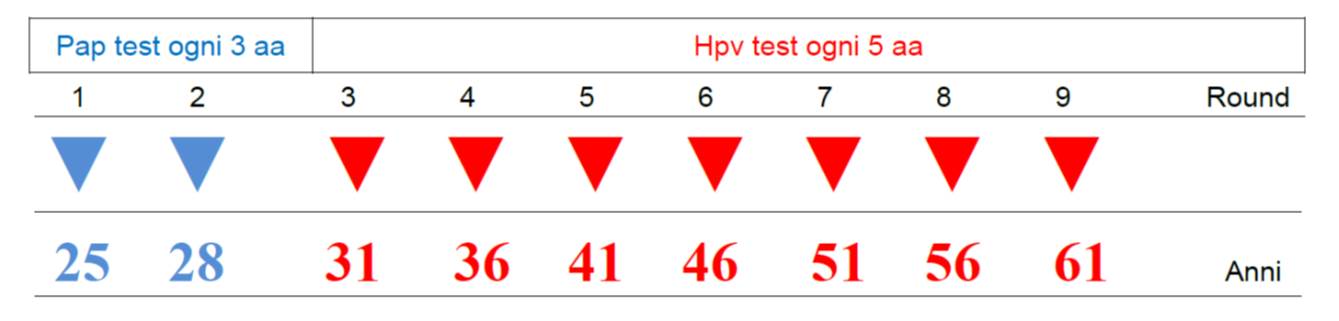
L’intervallo di screening dopo un test HPV primario negativo deve essere di almeno 5 anni. Ci sono prove che il rischio di lesioni precancerose di alto grado e di carcinoma del collo dell’utero fino a 5 anni dopo un test HPV negativo è inferiore a quello fino a 3 anni dopo una citologia normale, mentre la probabilità di colposcopie e trattamenti inutili sarebbe invece plausibilmente rilevante con intervalli triennali dopo test HPV negativo.
In Regione FVG, le donne verranno chiamate ad eseguire il test HPV dal compimento dei 30 anni e fino a 64 anni di età, con un intervallo di 5 anni dopo un test HPV primario negativo.
Protocollo con PAP TEST - Donne tra 25 e 29 anni di età
Le donne di età compresa tra 25 e 29 anni saranno invitate ad eseguire il Pap test come test primario ad intervalli triennali. Al compimento dei 30 anni rientreranno nella fascia di età in cui è previsto il test HPV come test primario, dismettendo la citologia.
Protocollo
Dovrà essere effettuato un unico prelievo con tecnica in fase liquida e citologia in strato sottile.
La diagnosi citologica verrà classificata secondo il sistema TBS 2001.
- In caso di esame negativo: - la donna viene invitata a ripetere il Pap test dopo 3 anni.
- In caso di preparato inadeguato: - la donna viene contattata per un nuovo appuntamento. Qualora persistesse l'inadeguatezza del preparato, la donna viene inviata al 2° livello (colposcopia).
- In caso di esame positivo con lesione di tipo ASC-US: - viene effettuato il triage con il test HPV-HR poiché l'ASC-US presenta un Valore Predittivo Positivo molto basso (VPP 5%) per lesioni di alto grado, ma rappresenta più del 50% delle anomalie citologiche al Pap test. Nel caso in cui il test HPV di triage sia positivo, la donna viene inviata al 2° livello (colposcopia).
- Tutti gli altri esiti citologici (L-SIL, ASC-H, H-SIL, CARCINOMA, AGC) vengono inviati direttamente al ° livello (colposcopia).
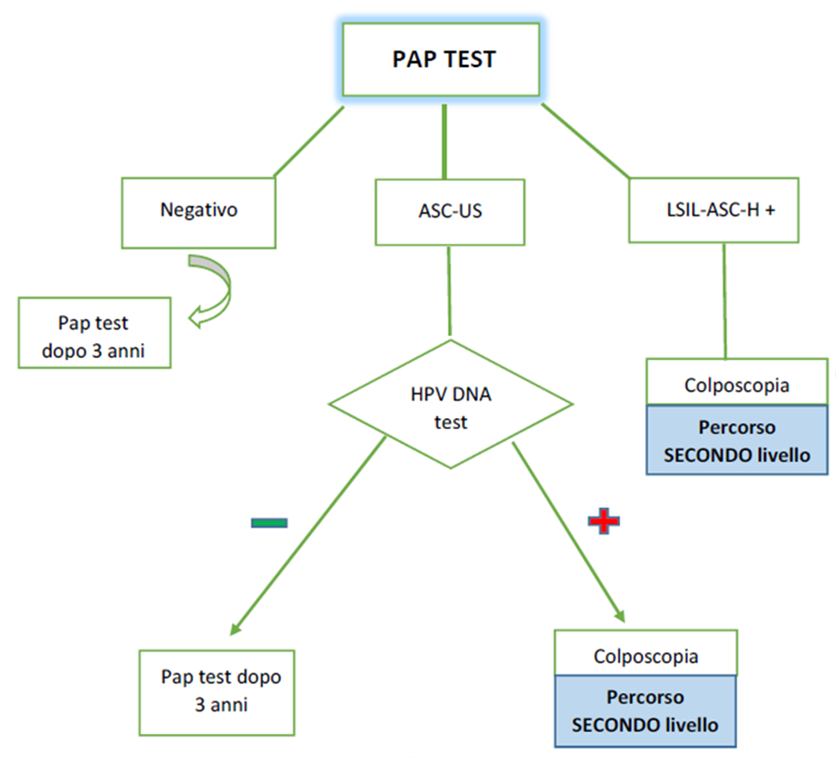
NB: Per le donne ASC-US/HPV-hr positivo con approfondimento di 2° livello negativo per CIN2+ è prevista la ripetizione di un test HPV-hr dopo 1 anno: - in caso di test HPV-hr negativo la donna rientra nello screening; - in caso di test HPV-hr positivo la donna viene invitata a ripetere il pap test e la colposcopia. In quest’ultimo caso, se anche il nuovo approfondimento di 2° livello sarà negativo per CIN2+, la donna sarà invitata a ripetere il HPV-hr dopo 12 mesi. In caso di HPV-hr negativo, la donna rientrerà nei normali intervalli di screening. In caso di positività la donna sarà invitata a ripetere la colposcopia e Pap test.
Protocollo con HPV DNA TEST -Donne tra 30 e 64 anni di età
Le donne di età compresa tra 30 e 64 anni saranno invitate ad eseguire il test HPV come test primario ad intervalli quinquennali.
Si specifica che tra i diversi test che rilevano la presenza dell’infezione da HPV, attualmente gli unici validati come test primari per lo screening cervicale sono i test per la ricerca del DNA virale.
Dovranno essere utilizzati i test per la presenza di DNA di tipi oncogeni (IARC) di Papilloma-Virus Umano, validati quanto a sensibilità e specificità per lesioni di alto grado, secondo quanto previsto dalle Linee Guida Europee.
Si evidenzia inoltre la necessità dell’adozione all’interno del programma di screening cervicale di protocolli che prevedano l’introduzione del test HPV-hr nel follow-up delle anormalità citologiche e delle donne trattate per lesioni precancerose.
Protocollo Dovrà essere effettuato un unico prelievo con tecnica in fase liquida.
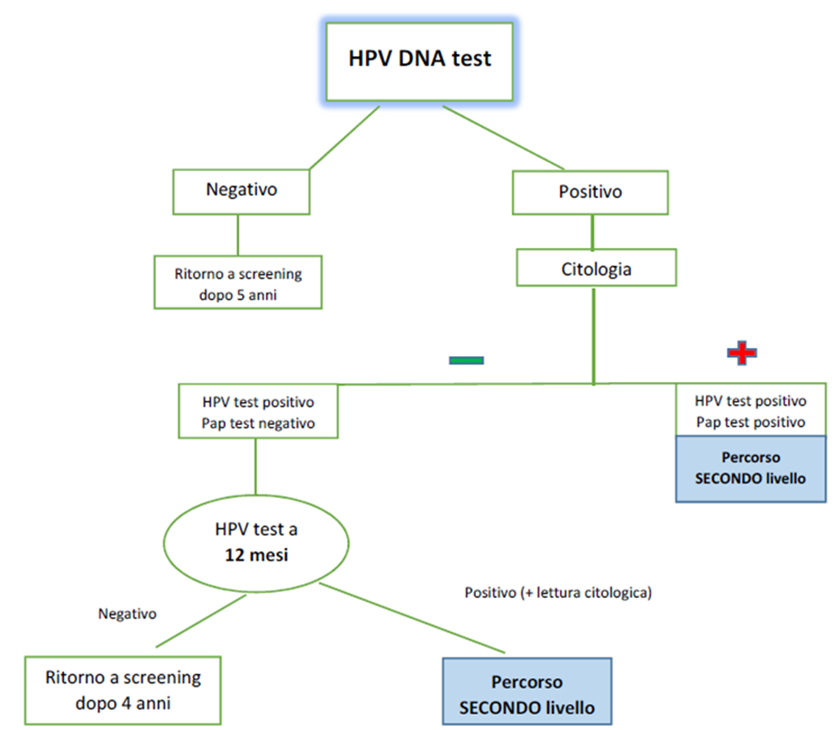
Negatività al test HPV
Le donne negative al test HPV saranno inviate a nuovo round di screening dopo 5 anni.
Positività al test HPV
Le donne positive al test HPV saranno sottoposte a triage basato sull’esecuzione della citologia. La diagnosi citologica verrà classificata secondo il sistema TBS 2001.
Le donne con citologia di triage positiva (categorie diagnostiche ASC-US, ASC-H, AGC, LSIL, HSIL, CTM) o inadeguata, saranno invitate ad eseguire la colposcopia. Le donne con citologia di triage negativa per due volte consecutive saranno invitate a ripetere il test HPV dopo 12 mesi.
Ripetizione del test HPV a 12 mesi
Le donne con test HPV negativo saranno inviate a nuovo round di screening dopo 4 anni.
Le donne con test HPV positivo saranno invitate ad eseguire la colposcopia.
La lettura del Pap test sarà eseguita solo in caso di positività al test HPV.
Approfondimenti di secondo livello
Le donne inviate in colposcopia verranno gestite secondo i protocolli di secondo livello correntemente utilizzati dai programmi di screening. In caso di diagnosi di lesioni CIN2 o superiore (CIN2+) verrà indicato l’opportuno trattamento. In caso di approfondimento negativo per CIN2+ le donne saranno invitate a follow-up.
Follow-up post-colposcopico e post-trattamento
Per il follow-up post-colposcopico e post-trattamento sono utilizzate le raccomandazioni del Gruppo Italiano Screening Cervicocarcinoma (GISCi) e della Società Italiana di Colposcopia e Patologia Cervico Vaginale (SICPCV).
Nel follow-up successivo ad un approfondimento di secondo livello negativo o post trattamento, il protocollo prevede di sfruttare l’alto valore predittivo negativo del test HPV, per ridurre il numero di controlli in caso di test negativo per le donne di tutte le età, mentre il Pap test è utilizzato per aumentare la specificità dell’algoritmo e per meglio indirizzare gli approfondimenti colposcopici; infine la colposcopia è utilizzata per individuare e diagnosticare istologicamente le lesioni da trattare.
In generale, un uso razionale dei test permette di concentrare le risorse del secondo livello sul gruppo di pazienti più a rischio.
Strategie per le donne vaccinate contro HPV
Per la popolazione vaccinata contro l’HPV durante il dodicesimo anno di vita (+/- 1 anno), secondo le raccomandazioni del GISCi, l’inizio del percorso di screening verrà posticipato a 30 anni utilizzando il test HPV come test primario ad intervalli quinquennali.
Per la popolazione non vaccinata, vaccinata in modo incompleto o vaccinata durante il 15° anno di vita, le indicazioni, al momento, indicano di seguire i protocolli già descritti per la popolazione generale.
Modalità di avvio del programma
Per garantire una riconversione del programma graduale e senza eccessive oscillazioni nel numero di inviti allo screening e negli esami da effettuare tra un anno e l’altro, si è proceduto ad organizzare una fase di transizione al fine di bilanciare i carichi di lavoro nel passaggio da 3 a 5 anni d’intervallo dello screening.
La ripartizione delle donne, per garantire carichi di lavoro omogenei, prevede che nel primo anno di transizione solo le donne nella fascia d’età 50-64 verranno screenate con HPV-DNA test (la fascia d’età 29-49 continuerà a utilizzare il PAP test), nel secondo anno le donne di età compresa tra 46-64 (mentre 29-45 con PAP test) e nel terzo anno le donne tra 41-64 anni. Dal quarto anno in poi il test HPV-DNA sarà l’unico test in uso per le donne di 30-64 anni, mentre il PAP test rimarrà per la fascia 25-29 anni.

Dati di riferimento nazionali
Tassi nazionali HPV primario del 2013 per le donne con hpv la primo livello.
HPV-DNA positivo al primo livello: 7%.
PAP test di triage positivo: 35% delle donne con hpv test postivo -> Invio in colposcopia.
PAP test di triage negativo: 65% -> HPV-DNA test a un anno.
Colposcopie a 1 anno: 50% dei casi con HPV-DNA test a un anno.
Implicazioni organizzative
Le modalità di chiamata per invito e sollecito verranno gestite dalle Segreterie organizzative aziendali secondo le modalità già in essere.
Centri di prelievo
Lo screening basato sul test HPV coesiste con lo screening citologico in quanto entrambi i test possono essere, a seconda dell’età della donna, test primari o test di triage.
La modalità di prelievo prescelta è quella del prelievo unico sul contenitore con liquido preservante, in modo da permettere sia la ricerca dell’HPV sia la lettura della citologia in strato sottile.
L’attività di prelievo dovrà coinvolgere tutti i Distretti/Consultori familiari della rete regionale, già operativi nei programmi di screening cervicale attivati, in modo da garantire la massima capillarità territoriale.
Il personale che effettua il prelievo dovrà essere adeguatamente formato sulle caratteristiche del nuovo programma di screening in modo tale da poter informare correttamente le donne e migliorare la compliance al Programma.
Gli ambulatori dove si effettuano i prelievi devono essere dotati di computer con accesso al software gestionale regionale dello screening, in modo da consentire al personale che effettua il prelievo di registrare la presenza della donna ed i relativi dati. Il tempo medio per un prelievo, globalmente comprensivo di anamnesi e consenso informato e l’inserimento dei dati nel software gestionale screening può essere stimato mediamente in 5 minuti per donna; su questo dato si devono basare i carichi di lavoro.
Centralizzazione dell’attività di Laboratorio (HPV e citologia)
Secondo le indicazioni del GISCi il numero di campioni gestito nell'arco di un anno da un laboratorio HPV non deve essere inferiore a 40.000 test e può arrivare fino a 100.000 o più. Comparando questi dati con i carichi di lavoro stimati a livello regionale, appare evidente come anche in Friuli Venezia Giulia vi sia la forte necessità di una centralizzazione in un unico Laboratorio al fine di mantenere elevati gli standard di qualità e di sicurezza di tutto il processo.
Tale laboratorio unico è individuato nell’ambito della rete regionale delle anatomie patologiche, nella Struttura Complessa di Anatomia ed Istologia Patologica di Trieste, che assumerà la responsabilità tecnico-operativa ed organizzativa di tutta l’attività.
La centralizzazione delle attività comporta:
- la programmazione concordata e coordinata dell’invio dei campioni tra centri screening e laboratorio unico, al fine di generare flussi di attività regolari e gestibili, secondo una tempistica di risposta conforme agli standard GISCi;
- la creazione di punti di raccolta dei campioni prelevati dai singoli centri di prelievo;
- la definizione di una procedura uniforme per il trasporto in sicurezza dei campioni prelevati (nel rispetto della normativa di riferimento e secondo le modalità di conservazione indicate dal produttore del mezzo di trasporto);
- la definizione di procedure di gestione dei campioni e della loro movimentazione tra laboratorio HPV e centro di lettura del Pap test, a seconda degli esiti (citologia di primo livello e di triage, HPV test di primo livello e di triage).
Le indicazioni nazionali contenute nelle Linee Guida ministeriali del 2006 prevedono centri di lettura con carichi di lavoro minimi compresi fra 15.000 e 25.000 PAP test/anno e un carico per lettore di circa 7500 PAP test/anno e il numero di campioni gestito nell’arco di un anno da un laboratorio HPV centralizzato deve essere non inferiore a 10000 test annui .
Adeguamento sistema informativo screening
Un pre-requisito fondamentale per l’avvio del programma di screening con l’HPV test è l’aggiornamento del sistema informativo: infatti il test HPV coesiste con il Pap test sia nella fase transitoria che a regime ed entrambi i test possono essere, a seconda dell’età della donna, test primari o test di triage. L'applicativo gestionale del programma di screening deve essere quindi aggiornato con nuove funzionalità per garantire la gestione dei due differenti protocolli operativi e percorsi previsti in base alla fascia di età delle donne, sia nella fase transitoria che a regime, e il monitoraggio dell’attività svolta.
Formazione degli operatori
L’introduzione di una strategia innovativa richiede un’adeguata attività di formazione rivolta a tutti gli operatori coinvolti nel percorso di screening cervicale.
Saranno pertanto organizzati corsi di formazione a livello regionale, organizzati con il supporto di una o più ASSL dell’ATS Sardegna nel ruolo di capofila regionale, per:
- operatori dei Centri screening,
- operatori dei Centri di prelievo,
- operatori del laboratorio unico regionale per lo screening del cervico carcinoma (HPV e citologia),
- operatori del secondo livello (ginecologi).
I contenuti dei Corsi, anche di tipo teorico – pratico, saranno diretti ad acquisire e/o perfezionare le competenze nei seguenti ambiti:
- comunicazione e councelling, nell’approccio per la partecipazione consapevole delle donne inserite nel nuovo percorso e per ridurre, in caso di esito positivo delle donne al test HPV, l’impatto emotivo e i possibili rischi (modalità inappropriate di gestione e perdita al follow up);



